Một dung dịch có chứa a mol HCO3-; 0,2 mol Ca2+; 0,8 mol Na+; 0,1 mol Mg2+; 0,8 mol Cl-. Cô cạn dung dịch đó đến khối lương không đổi thì lượng muối khan thu được là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cô cạn : 2HCO3- → C O 3 2 - + CO2 + H2O
Bảo toàn điện tích: n HCO3- = 0,6 mol => n CO32- = 0,3 mol
=> tạo 0,1 mol MgCO3 và 0,2 mol CaCO3
=> dung dịch còn 0,8 mol NaCl
=> m muối khan = m NaCl + m MgCO3 + m CaCO3 = 75,2g
=>A

Chọn đáp án A.
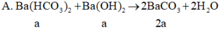
=> mkết tủa = 197 . 2 a = 394 a g

=> mkết tủa = 233 a g
![]()
=> mkết tủa = 197 a + 100 a = 297 a g
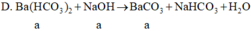
=> mkết tủa = 197 a g
Vậy trường hợp A thu được khối lượng kết tủa lớn nhất.

Đáp án A
Định hướng tư duy giải
Dễ dàng nhận thấy ngay: B a H C O 3 2 + B a O H 2 → 2 B a C O 3 (197.2a gam)

Đáp án A
Dễ dàng nhận thấy ngay: Ba(HCO3)2 + Ba(OH)2 → 2BaCO3 (197.2a gam)
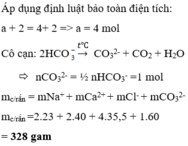

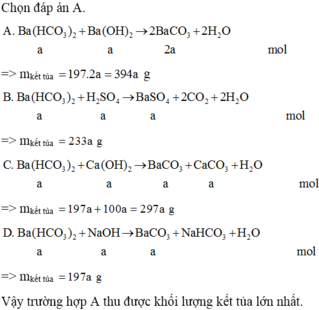
Đáp án C
Bảo toàn điện tích : nHCO3- + nCl- = 2nCa2+ + nNa+ + 2nMg2+
=> nHCO3- = 0,6 mol
2HCO3- -> CO32- + CO2 + H2O
0,6 -> 0,3 mol
Cô cạn dung dịch thu được muối khan gồm (Ca2+ ; Na+ ; Mg2+ ; Cl- ; CO32-)
=> mmuối khan = 75,2g
=>C