Nồng mol/lít của dung dịch HBr 16,2% (d = 1,02 g/ml) là :
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : A
Ta thấy chất rắn D gồm toàn oxit của Mg (và có thể của Fe) có m < mA
=> chứng tỏ A không phản ứng hết mà có kim loại dư.
Giả sử Fe chỉ phản ứng 1 phần với số mol là x; nMg = y
=> CuSO4 hết
=> moxit = mMgO + m F e 2 O 3 = 40y + 80x = 0,9g
Lại có : mB – mA = mCu – mMg – mFe pứ
=> 1,38 – 1,02 = 64.(x + y) – 24y – 56x
=> x = y = 0,0075 mol
=> n C u S O 4 = x + y = 0,015 mol
=> C M C u S O 4 = 0,075M

Chọn A

=> NaOH dư, C O 2 hết, phản ứng thu được muối N a 2 C O 3
C O 2 + 2 N a O H → N a 2 C O 3 + H 2 O 0 , 5 m o l → 0 , 5 m o l
![]()

\(n_{Na_2O}=\dfrac{15,5}{62}=0,25\left(mol\right)\\ PTHH:Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=2.0,25=0,5\left(mol\right)\\ a,C_{MddNaOH}=\dfrac{0,5}{0,5}=1\left(M\right)\\ b,2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ n_{H_2SO_4}=n_{Na_2SO_4}=\dfrac{0,5}{2}=0,25\left(mol\right)\\ m_{H_2SO_4}=0,25.98=24,5\left(g\right)\\ m_{ddH_2SO_4}=\dfrac{24,5.100}{20}=122,5\left(g\right)\\ V_{ddH_2SO_4}=\dfrac{122,5}{1,14}\approx107,456\left(ml\right)\\ c,V_{ddsau}=V_{ddNaOH}+V_{ddH_2SO_4}\approx0,5+0,107456=0,607456\left(l\right)\\C_{MddNa_2SO_4}\approx\dfrac{ 0,25}{0,607456}\approx0,411552\left(M\right)\)

nH2 = 85,12 : 22,4 = 3,8 (mol) ; nH2O = VH2O.D = 108 (g) => nH2O = 108/18 = 6 (mol)
PTHH:
2Na + 2C2H5OH → 2C2H5ONa + H2↑
x → 0,5x (mol)
2Na + 2H2O → 2NaOH + H2↑
6 → 3 (mol)
Ta có: nH2 = 0,5x + 3 = 3,8
=> x = 1,6 (mol) = nC2H5OH
mC2H5OH = 1,6.46 = 73,6 (g)
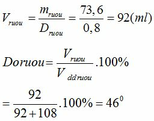

Bạn ơi d = gam / ml nha
Ta có mAgNO3 = V . D = 500 . 1,2 = 600 ( gam )
mHCl = V . D = 300 . 1,5 = 450 ( gam )
a, Gọi CM AgNO3 là C1
CM HCl là C2
Nồng độ mol của dung dịch cần tìm là C
VAgNO3 là V1
VHCl là V2

=> \(\dfrac{500}{300}\) = \(\dfrac{\left|2-C\right|}{\left|1-C\right|}\)
=> CM càn tìm = 1,375 M

a, \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(m_{CuCl_2}=270.10\%=27\left(g\right)\Rightarrow n_{CuCl_2}=\dfrac{27}{135}=0,2\left(mol\right)\)
Ta có: \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\) ⇒ Fe hết, CuCl2 dư
PTHH: Fe + CuCl2 ---> FeCl2 + Cu
Mol: 0,15 0,15 0,15 0,15
\(a=m_{Cu}=0,15.64=9,6\left(g\right)\)
b, \(m_{dd.sau.pứ}=8,4+270-9,6=268,8\left(g\right)\)
\(m_{CuCl_2dư}=\left(0,2-0,15\right).135=6,75\left(g\right)\)
\(\left\{{}\begin{matrix}C\%_{CuCl_2dư}=\dfrac{6,75.100\%}{268,8}=2,51\%\\C\%_{FeCl_2}=\dfrac{0,15.127.100\%}{268,8}=7,09\%\end{matrix}\right.\)
c, \(V_{ddCuCl_2}=\dfrac{270}{1,35}=200\left(ml\right)=0,2\left(l\right)\)
\(\left\{{}\begin{matrix}C_{M_{CuCl_2dư}}=\dfrac{0,2-0,15}{0,2}=0,25M\\C_{M_{FeCl_2}}=\dfrac{0,15}{0,2}=0,75M\end{matrix}\right.\)

\(n_{H_2SO_4}=0.1\cdot2=0.2\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=100\cdot1.2=120\left(g\right)\)
\(n_{BaCl_2}=0.1\cdot1=0.1\left(mol\right)\)
\(m_{dd_{BaCl_2}}=100\cdot1.32=132\left(g\right)\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(0.1................0.1.........0.1...............0.2\)
\(\Rightarrow H_2SO_4dư\)
\(m_{BaSO_4}=0.1\cdot233=23.3\left(g\right)\)
\(V_{dd}=0.1+0.1=0.2\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2-0.1}{0.2}=0.5\left(M\right)\)
\(C_{M_{HCl}}=\dfrac{0.2}{0.2}=1\left(M\right)\)
\(m_{\text{dung dịch sau phản ứng}}=120+132-23.3=228.7\left(g\right)\)
\(C\%_{H_2SO_4\left(dư\right)}=\dfrac{0.1\cdot98}{228.7}\cdot100\%=4.28\%\)
\(C\%_{HCl}=\dfrac{0.2\cdot36.5}{228.7}\cdot100\%=3.2\%\)

\(n_{Fe}=\dfrac{8,4}{56}=0,15mol\)
\(m_{CuCl_2}=\dfrac{270\cdot10\%}{100\%}=27g\Rightarrow n_{CuCl_2}=0,2mol\)
\(Fe+CuCl_2\rightarrow FeCl_2+Cu\)
0,15 0,2 0,15 0,15
\(a=m_{Cu}=0,15\cdot64=9,6g\)
\(m_{FeCl_2}=0,15\cdot127=19,05g\)
\(m_{ddFeCl_2}=8,4+270-0,15\cdot64=268,8g\)
\(C\%=\dfrac{19,05}{268,8}\cdot100\%=7,09\%\)


Đáp án A
=>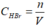 = 2,04M
= 2,04M