Muối nào trong đó có kim loại hóa trị II trong các muối sau: A l 2 S O 4 3 ; N a 2 S O 4 ; K 2 S O 4 ; B a C l 2 ; C u S O 4
A. K 2 S O 4 ; B a C l 2
B. A l 2 S O 4 3
C. B a C l 2 ; C u S O 4
D. N a 2 S O 4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Gọi công thức chung của hai muối là : \(M_2\left(SO_4\right)_n\)
\(PTHH:M_2\left(SO_4\right)_n+nBaCl_2\rightarrow nBaSO_4+2MCl_n\)
................0,03/n..................................0,03................
\(\Rightarrow\dfrac{0,03}{n}=\dfrac{3,82}{2M+96n}\)
\(\Rightarrow M=\dfrac{47}{3}n\)
Mà \(1< n< 2\)
\(\Rightarrow\dfrac{47}{3}< \dfrac{47}{3}n< \dfrac{94}{3}\)
\(\Rightarrow\dfrac{47}{3}< M< \dfrac{94}{3}\)
Nên A và B có thể là : Na và Mg .
- Gọi Na2SO4 và MgSO4 có mol là a, b .
b, \(BT_{SO_4^{-2}}=a+b=0,03\)
\(PTKL:142a+120b=3,82\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,01\\b=0,02\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Na2SO4}=1,42g\\m_{MgSO4}=2,4g\end{matrix}\right.\)
a, \(m_{MCl}=m_{NaCl}+m_{MaCl2}=2,485g\)
Câu b á thiếu dữ kiện nhe (mk bổ sung thêm là 2 kl này phải cùng vị trị chu kì )
a) PTHH: A2SO4+BaCl2 \(\rightarrow\) 2ACl+BaSO4
BSO4+BaCl2 \(\rightarrow\) BCl2+BaSO4
nBaCl2 = nBaSO4 = \(\dfrac{6.99}{233}\) = 0,03mol
\(\Rightarrow\)mBaCl2 = 0,03.208 = 6,24g.
b)mhh =3,82g
nSO4(2-)=0,03mol
-Nếu hh chỉ có A2SO4, MA2SO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_A=15,67\)
-Nếu hh chỉ có BSO4, MBSO4\(=\dfrac{3,82}{0,03}=127,33\rightarrow M_B=31,33\)
Mà hh có cả A2SO4 và BSO4 nên
15,67 Mà A,B ở cùng chu kỳ nên A là Na (23) và B là Mg (24)

Cho dung dịch NaOH vào dung dịch muối sunfat của kim loại hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Đó là muối nào sau đây?
A. MgSO4.
B. CaSO4.
C. MnSO4.
D. ZnSO4.
\(2NaOH+ZnSO_4\rightarrow Zn\left(OH\right)_2+Na_2SO_4\\ Zn\left(OH\right)_2+2NaOH\rightarrow Na_2ZnO_2+2H_2O\)

Đáp án D.
PTHH:
2NaOH + ZnSO4 → Na2SO4 + Zn(OH)2↓
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O

Theo ĐLBT KL, ta có: m muối cacbonat = m chất rắn + mCO2
⇒ mCO2 = 13,4 - 6,8 = 6,6 (g)
\(\Rightarrow n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
Có: \(n_{NaOH}=0,075.1=0,075\left(mol\right)\)
\(\Rightarrow\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,075}{0,15}=0,5\)
Vậy: Pư tạo muối NaHCO3.
PT: NaOH + CO2 → NaHCO3
___0,075__________0,075 (mol)
⇒ mNaHCO3 = 0,075.84 = 6,3 (g)
Bạn tham khảo nhé!

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
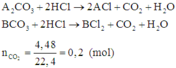
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

a)
\(n_{H_2} = \dfrac{3,808}{22,4} = 0,17(mol)\\ \Rightarrow n_{HCl} = 2n_{H_2} = 0,17.2 = 0,34(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 4 + 0,34.36,5 - 0,17.2 = 16,07(gam)\)
b)
\(n_A = a(mol) \Rightarrow n_{Al} =5a(mol)\\ A + 2HCl \to 2ACl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + H_2\\ n_{H_2} = n_A + \dfrac{3}{2}n_{Al} = a + \dfrac{3}{2}.5a = 0,17\\ \Rightarrow a = 0,02\\ m_{hỗn\ hợp} = 0,02A + 0,02.5.27 = 4\\ \Rightarrow A = 65(Zn)\)
Vậy kim loại hóa trị II cần tìm là Kẽm.

\(Đặt:n_A=x\left(mol\right),n_{NO}=a\left(mol\right),n_{NO_2}=b\left(mol\right)\)
\(Giảsử:n_{khí}=1\left(mol\right)\)
\(\Rightarrow a+b=1\left(mol\right)\left(1\right)\)
\(\overline{M_{khí}}=\dfrac{30a+46b}{a+b}=20\cdot2\)
\(\Leftrightarrow30a+46b=40\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.375,b=0.625\)
\(BTe:2n_A=3n_{NO}+n_{NO_2}\Rightarrow n_A=\dfrac{3\cdot0.375+0.625}{2}=0.875\left(mol\right)\)
\(m_{A\left(NO_3\right)_2}=0.875\cdot\left(A+124\right)=66.15\left(g\right)\\ \Rightarrow A=\)
Đến đây bạn xem lại đề nhé.

Câu 5:
Ta có: \(n_{H_2}=\dfrac{14,874}{24,79}=0,6\left(mol\right)\)
Gọi: nA = 3x (mol) ⇒ nB = 2x (mol)
PT: \(A+2HCl\rightarrow AlCl_2+H_2\)
\(2B+6HCl\rightarrow2BCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_A+\dfrac{3}{2}n_B\)
⇒ 0,6 = 3x + 3/2.2x
⇒ x = 0,1 (mol)
⇒ nA = 0,3 (mol), nB = 0,2 (mol)
Mà: mA + mB = 24,9
⇒ 0,3.MA + 0,2.MB = 24,9
\(\Rightarrow M_A=\dfrac{24,9-0,2M_B}{0,3}>60\)
⇒ MB < 34,5 (g/mol) → MB = 27 (g/mol) → Al
MA = 65 (g/mol) → Zn
Câu 6:
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\) ⇒ 24x + 65y = 19,85 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{MgCl_2}=n_{Mg}=x\left(mol\right)\\n_{ZnCl_2}=n_{Zn}=y\left(mol\right)\end{matrix}\right.\)
\(n_{HCl\left(pư\right)}=2n_{Mg}+2n_{Zn}=2x+2y\left(mol\right)\)
⇒ nHCl (dư) = (2x + 2y).20% (mol)
⇒ 95x + 136y + (2x + 2y).20%.36,5 = 54,09 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{19,85}.100\%\approx18,14\%\\\%m_{Zn}\approx81,86\%\end{matrix}\right.\)
b, Ta có: nHCl (pư) = 0,15.2 + 0,25.2 = 0,8 (mol) ⇒ nH2 = 1/2nHCl = 0,4 (mol)
nHCl (dư) = 0,8.20% = 0,16 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{\left(0,8+0,16\right).36,5}{29,2\%}=120\left(g\right)\)
⇒ m dd sau pư = 19,85 + 120 - 0,4.2 = 139,05 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,16.36,5}{139,05}.100\%\approx4,20\%\\C\%_{MgCl_2}=\dfrac{0,15.95}{139,05}.100\%\approx10,25\%\\C\%_{ZnCl_2}=\dfrac{0,25.136}{139,05}.100\%\approx24,45\%\end{matrix}\right.\)
Đáp án C