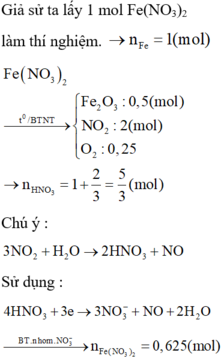Khử hoàn toàn 16g bằng CO thành Fe và Tính khối lượng chất rắn thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a) \(n_{Fe_2O_3}=\frac{32}{160}=0,2\left(mol\right)\)
PTHH : \(Fe_2O_3+3H_2-t^o->2Fe+3H_2O\)
Theo pthh : \(n_{H_2}=3n_{Fe_2O_3}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6\cdot22,4=13,44\left(l\right)\)
b) Theo pthh : \(n_{H_2O}=n_{H_2}=0,6\left(mol\right)\)
=> \(m_{H_2O}=0,6\cdot18=10,8\left(g\right)\)
c) Theo pthh : \(n_{Fe}=2n_{Fe_2O_3}=0,4\left(mol\right)\)
=> \(m_{Fe}=0,4\cdot56=22,4\left(g\right)\)

a. áp dụng định luật bảo toàn nguyên tố
=> 4,8 g là khối lượng O trong oxit sắt
=> nO = 0,3 ; nFe = 0,2
CT oxit sắt là Fe2O3
b. Fe2O3 + 3CO ---> 2Fe + 3CO2
nCO = 0,3 mol
dùng dư 10% => nCO = 0,3 x 110% = 0,33 mol
CÂU C BN TỰ LM NHA, LƯỜI WÁ![]()
Gọi công thức oxit sắt:Fex0y.
Fex0y+yCO=>xFe+yC02
0.2/x------------>0.2(mol)
_Sau pư khối lượng chất rắn giảm 4.8 g so với ban đầu:
=>mFe=16-4.8=11.2(g)
=>nFe=11.2/56=0.2(mol)
=>n(Fex0y)=0.2/x(mol)
Mà nFex0y=16/(56x+16y) (mol)
=>16x=0.2(56x+16y)
<=>4.8x=3.2y
<=>x/y=2/3
Vậy công thức oxit sắt là Fe203.
_Khí sinh ra là C02 cho tác dụng với dd NaOH:
nC02=0.2*3=0.6(mol)
_Khối lượng dd tăng cũng chính là khối lượng C02 tham gia:
C02+2NaOH=>Na2S03+H20
0.6--->1.2-------->0.6(mol)
=>mC02=0.6*44=26.4(g)

Theo đề bài ta có : nkt = nBaCO3 = 1,97/197 = 0,01 (mol)
PTHH :
FeO+CO−t0−>Fe+CO2↑FeO+CO−t0−>Fe+CO2↑
Fe2O3+3CO−t0−>2Fe+3CO2↑Fe2O3+3CO−t0−>2Fe+3CO2↑
Fe3O4+4CO−t0−>3Fe+4CO2↑Fe3O4+4CO−t0−>3Fe+4CO2↑
CO2 + Ba(OH)2 - > BaCO3↓↓ + H2O
0,01mol........................0,01mol
Theo các PTHH ta có : nCo = nCo2 = 0,01 mol
Áp dụng đlbtkl ta có :
mX + mCO = mY + mCO2
=> mY = 4,64 + 0,01.28 - 0,01.44 = 4,48(g)
Vậy....

Ta có: nCO = \(\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> nC = 0,25 (mol)
Ta có: nCO2 (tạo thành) = nC = 0,25 (mol)
=> mc.rắn = moxit + mCO - mCO2 = 30 + 0,25 . 28 - 0,25 . 44 = 26 (gam)
=> Chọn đáp án B

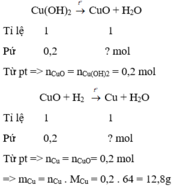
a) \(2Fe\left(OH\right)_3-^{t^o}\rightarrow Fe_2O_3+3H_2O\)
\(Cu\left(OH\right)_2-^{t^o}\rightarrow CuO+H_2O\)
Gọi x,y lần lượt là số mol Fe(OH)3 và Cu(OH)2
=> \(\left\{{}\begin{matrix}107x+98y=20,5\\160.\dfrac{x}{2}+80y=16\end{matrix}\right.\)
=> x= 0,1 ; y=0,1
=> \(\%m_{Fe\left(OH\right)_3}=\dfrac{0,1.107}{20,5}.100=52,2\%\)
\(\%m_{Cu\left(OH\right)_2}=47,8\%\)
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
\(n_{H_2SO_4}=0,1.\dfrac{3}{2}+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
\(m_{ddsaupu}=20,5+122,5=143\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{143}.100=13,97\%\)
\(C\%_{CuSO_4}=\dfrac{0,1.160}{143}.100=11,19\%\)
c) \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{Fe_2O_3}=0,05\left(mol\right);n_{CuO}=0,1\left(mol\right)\)
=> \(n_{H_2SO_4}=0,05.3+0,1=0,25\left(mol\right)\)
\(m_{ddH_2SO_4\left(pứ\right)}=\dfrac{0,25.98}{20\%}=122,5\left(g\right)\)
=> \(m_{ddH_2SO_4\left(bđ\right)}=122,5.110\%=134,75\left(g\right)\)

a) Fe2O3 + 3CO \(\rightarrow\) 2Fe + 3CO2 (1)
x 3x 2x
Fe3O4 + 4CO \(\rightarrow\) 3Fe + 4CO2 (2)
y 4y 3y
b) Số mol khí CO = 11,2/22,4 = 0,5 mol. Gọi x, y tương ứng là số mol của hai oxi nói trên. Ta có:
160x + 232y = 27,6 và 3x + 4y = 0,5. Giải hệ thu được x = 0,1 và y = 0,05 mol.
%Fe2O3 = 160.0,1.100/27,6 = 57,97%; %Fe3O4 = 100 - 57,97 = 42,03 %.
c) Khối lượng Fe ở p.ư (1) = 56.2.0,1 = 11,2 g; ở p.ư (2) = 56.3.0,05 = 8,4 g.