So sánh tính chất hóa học của O2 và O3 . Viết phương trình phản ứng minh họa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mình nghĩ cái này thuộc kiến thức cơ bản, bạn nên tự học trong SGK thì hơn là đi đăng câu hỏi ở Hoc24

* Oxi:
- Tác dụng với phi kim:
PTHH:C+O2---to--->CO2
- Tác dụng với kim loại:
PTHH:3Fe+2O2--to--->Fe3O4
- Tác dụng với hợp chất:
PTHH:C2H4+3O2--to--->2CO2+2H2O
* Hiđrô:
- Tác dụng với oxi:
PTHH:2H2+O2--to--->2H2O
- Tác dụng với đồng (II) oxit:
PTHH:CuO+H2--to--->Cu+H2O
* Nước:
- Tác dụng với một số kim loại:
PTHH:2Na+2H2O→2NaOH+H2↑
- Tác dụng với oxit axit:
PTHH:SO3+H2O→H2SO4
- Tác dụng với oxit bazơ:
PTHH:BaO+H2O→Ba(OH)2

I.Khái niệm và phân loại
-Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (OH).
-Hóa trị của kim loại bằng số nhóm hidroxit
-Tên bazơ = tên kim loại (thêm hóa trị, nếu kim loại có nhiều hóa trị) + hidroxit
Ví dụ: NaOH: Natri hidroxit
Fe(OH)3: Sắt (III) hidroxit
-Dựa vào tính tan của bazơ trong nước, người ta chia bazơ thành 2 loại:
+ Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm):
Ví dụ: NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
+ Những bazơ không tan:
Ví dụ: Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
II. Tính chất hóa học
1) Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphthalein không màu đổi sang màu đỏ.
2) Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O
3) Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Ví dụ: KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Lưu ý: Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước
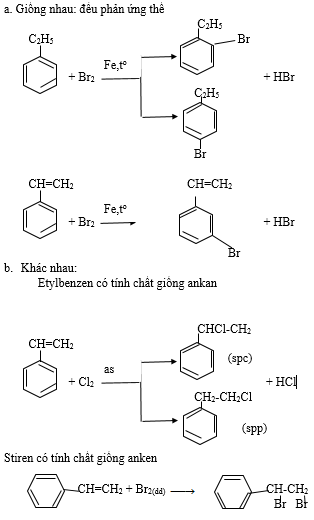


So sánh tính chất hóa học của O2 và O3 . Viết phương trình phản ứng minh hoạ
oxi
ozon
Là một phi kim hoạt động (do có độ âm điện lớn 3,44 chỉ kém F).
a. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Ag, Au và Pt) → oxit. Các phản ứng thường xảy ra ở nhiệt độ cao.
2Mg + O2 → 2MgO
3Fe + 2O2 → Fe3O4(thường tạo hỗn hợp 4 chất rắn)
b. Tác dụng với phi kim
– Oxi phản ứng với hầu hết các phi kim (trừ halogen) tạo thành oxit axit hoặc oxit không tạo muối.
– Các phản ứng thường xảy ra ở nhiệt độ cao.
S + O2→SO2
C + O2→CO2
2C + O2 → 2CO
N2 + O2 → 2NO (3000oC3000oC, có tia lửa điện)
c. Tác dụng với hợp chất có tính khử
2CO + O2→2CO2O2→2CO2
4FeS2+11O2→2Fe2O3+8SO2
– Có tính oxi hóa mạnh hơn Oxi:
O3+2KI+H2O→2KOH+I2+O22Ag+O3→Ag2O+O2 (phản ứng xảy ra ngay ở nhiệt độ thường).
- Tính chất hóa học của O3 có tính oxi hóa mạnh hơn Oxi
\(O_3+2KI+H_2O\rightarrow2KOH+I_2+O_2\)
\(2Ag+O_3\rightarrow Ag_2O+O_2\) (phản ứng xảy ra ngay ở nhiệt độ thường