1. Cho m gam Zn tác dụng với 500ml dd HCl 0,4 M . Tính thể tích khí H2 thu được ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề : 44,81 l khí thành 4,48l
Đặt : nFe = x(mol) , nZn = y(mol)
\(n_{H2}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
Pt : \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(\)Có hệ phương trình : \(\left\{{}\begin{matrix}56x+65y=12,1\\x+y=0,2\end{matrix}\right.\)
\(\Rightarrow x=0,1=n_{FeCl2},y=0,1=n_{ZnCl2}\)
\(\Rightarrow m_{muối}=m_{ZnCl2}+m_{FeCl2}=0,1.136+0,1.127=26,3\left(g\right)\)

\(n_{Zn}=\dfrac{2,6}{65}=0,04\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
a) Sửa đề : tính khối lượng ZnCl2 thu được
Theo Pt : \(n_{Zn}=n_{ZnCl2}=n_{H2}=0,04\left(mol\right)\)
\(\Rightarrow m_{ZnCl2}=0,04.136=5,44\left(g\right)\)
b) Theo Pt : \(n_{HCl}=2n_{Zn}=2.0,04=0,08\left(mol\right)\)\
\(C_{MddHCl}=\dfrac{0,08}{0,2}=0,4\left(M\right)\)
c) \(V_{H2\left(dktc\right)}=0,04.22,4=0,896\left(l\right)\)
Chúc bạn học tốt

\(a)n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=\left(0,1+0,2\right).22,4=6,72l\\ b)V_{ddHCl}=\dfrac{0,2+0,4}{2}=0,3l\\ c)m_{muối}=0,1.127+95.0,2=31,7g\)

400ml = 0,4l
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,1 0,1 0,1
a) \(n_{H2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
\(n_{ZnCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(C_{M_{ZnCl2}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\)
Chúc bạn học tốt

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)

Theo gt ta có: $n_{HCl}=0,1(mol)$
$Fe+2HCl\rightarrow FeCl_2+H_2$
a, Ta có: $n_{Fe}=0,05(mol)\Rightarrow m_{Fe}=2,8(g)$
b, Ta có: $n_{H_2}=0,05(mol)\Rightarrow V_{H_2}=1,12(l)$
\(n_{HCl}=C_M.V=0,1mol\)
a, \(PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\)
- Theo PTHH : nFe = 0,05mol
=> m = 2,8g
b, - Theo PTHH : nH2 = 0,05mol
=> V = 1,12l

nZn = 0.65 / 65 = 0.01 (mol)
Zn + 2HCl => ZnCl2 + H2
0.01..................0.01......0.01
mZnCl2 = 0.01 * 136 = 1.36 (g)
VH2 = 0.01 * 22.4 = 0.224 (l)
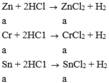
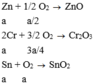
Zn +HCl ---->ZnCl2+H2 (1)
500ml =0,5
nHCl =0,5.0,4 =0,2mol
Từ (1) Ta có
nH2 =nHCl =0,2mol
VH2=0,2.22,4 =4,48l
500ml =0,5l
Zn +HCl ---->ZnCl2+H2
nHCl =0,5.0,4 =0,2mol
Theo ptTa có
nH2 =nHCl =0,2mol
VH2=0,2.22,4 =4,48l