Cho 7,2 g kim loại Mg phản ứng hoàn toàn với dung dịch HCl 6M. Xác định thể tích đ HCl cần dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


n Mg=\(\dfrac{7,2}{24}\)=0,3 mol
Mg+2HCl->MgCl2+H2
0,3-----0,6 mol
->VHCl=0,1l
=>CmHCl=\(\dfrac{0,6}{0,1}\)=6M
VHCl = 120/1,2 = 100 (ml) = 0,1 (l)
nMg = 7,2/24 = 0,3 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
Mol: 0,3 ----> 0,6
CmddHCL = 0,6/0,1 = 6M

Ta có ptpu
Mg+ 2HCl--> MgCl2+ H2
\(n_{Mg}\)= \(\frac{7,2}{24}\) = 0,3 ( mol)
Theo ptpu ta thấy \(n_{HCl}\)= \(2n_{Mg}\)= 0,6 ( mol)
=> \(m_{HCl}\)= 36,5 . 0,6 = 21,9 (g)
Nồng độ phần trăm của dung dịch HCl là
\(C\%=\frac{m_{ct}}{m_{dd}}=\frac{21,9}{100}.100=21,9\left(\%\right)\)

\(X+HCl\rightarrow XCl_2+H_2\)
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Leftrightarrow n_{HCl}=0.6\left(mol\right)\)
\(\Leftrightarrow n_X=0.3\left(mol\right)\)
\(M_X=\dfrac{7.2}{0.3}=24\)
=>X là magie
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: R + 2HCl → RCl2 + H2
Mol: 0,3 0,3
\(M_R=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
⇒ R là magie (Mg)

Để giải bài toán này, ta cần biết phương trình phản ứng giữa Fe và HCl: Fe + 2HCl -> FeCl2 + H2 a. Để xác định nồng độ dung dịch HCl cần dùng, ta cần tính số mol của Fe. Đầu tiên, ta cần chuyển khối lượng Fe thành số mol bằng cách sử dụng khối lượng mol của Fe (56g/mol): Số mol Fe = khối lượng Fe / khối lượng mol Fe = 5,6g / 56g/mol = 0,1 mol Vì theo phương trình phản ứng, 1 mol Fe tương ứng với 2 mol HCl, nên số mol HCl cần dùng là gấp đôi số mol Fe: Số mol HCl = 2 x số mol Fe = 2 x 0,1 mol = 0,2 mol Để tính nồng độ dung dịch HCl, ta chia số mol HCl cho thể tích dung dịch HCl: Nồng độ HCl = số mol HCl / thể tích dung dịch HCl = 0,2 mol / 0,1 L = 2 mol/L Vậy, nồng độ dung dịch HCl cần dùng là 2 mol/L. b. Để xác định khối lượng muối thu được sau phản ứng, ta cần tính số mol muối FeCl2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol FeCl2, nên số mol muối FeCl2 cũng là 0,1 mol. Khối lượng muối FeCl2 = số mol muối FeCl2 x khối lượng mol muối FeCl2 = 0,1 mol x (56g/mol + 2 x 35,5g/mol) = 0,1 mol x 127g/mol = 12,7g Vậy, khối lượng muối thu được sau phản ứng là 12,7g. c. Để xác định thể tích Hidro thu được sau phản ứng, ta cần tính số mol H2. Theo phương trình phản ứng, 1 mol Fe tương ứng với 1 mol H2, nên số mol H2 cũng là 0,1 mol. Thể tích H2 = số mol H2 x thể tích mol của H2 = 0,1 mol x 22,4 L/mol = 2,24 L Vậy, thể tích Hidro thu được sau phản ứng là 2,24 L.

Bài 1:
Gọi KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Ta có: \(n_{HCl}=0,1.6=0,6\left(mol\right)\)
Theo PT: \(n_A=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{7,2}{0,3}=24\left(g/mol\right)\)
Vậy: KL cần tìm là Mg.
Bài 2:
PT: \(2R+6HCl\rightarrow2RCl_3+3H_2\)
Ta có: \(n_{H_2}=\dfrac{9,408}{22,4}=0,42\left(mol\right)\)
Theo PT: \(n_R=\dfrac{2}{3}n_{H_2}=0,28\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{7,56}{0,28}=27\left(g/mol\right)\)
Vậy: R là Al.

a)
Gọi hóa trị của kim loại M là n
M + nHCl → MCln + n/2H2
nHCl = = 0,6 mol
nM = => MM = = 12n
=> Với n = 2 và MM = 24 g/mol là giá trị thỏa mãn
Kim loại M là Magie (Mg)
\(a,X+2HCl\rightarrow XCl_2+H_2\\ n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\\ n_X=n_{XCl_2}=n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ b,M_X=\dfrac{7,2}{0,3}=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow X:Magie\left(Mg=24\right)\\ c,m_{MgCl_2}=0,3.95=28,5\left(g\right)\\ d,V_{H_2\left(\text{đ}ktc\right)}=0,3.22,4=6,72\left(l\right)\)

C2:
PTHH: 2Al+6HCl →2AlCl3 +3H2
a)
Ta có:
\(+n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(+n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Biện luận:
\(\dfrac{0,3}{2}>\dfrac{0,6}{6}\)
⇒Al dư, HCl pư hết.
\(+n_{Al}\)dư =0,3-0,2=0,1(mol
\(+m_{Al}\)dư =0,1.27=2,7(gam)
b)
\(+n_{AlCl_3}=0,2\left(mol\right)\)
⇒\(m_{AlCl_3}=0,2.133,5=26,7\left(gam\right)\)
c) PTHH: H2+CuO→Cu+H2O
\(+n_{CuO}=n_{H_2}=0,3\left(mol\right)\)
\(+m_{CuO}=0,3.80=24\left(gam\right)\)
Chúc bạn học tốt.
\(1.\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2N+2nHCl\rightarrow2NCl_n+nH_2\)
\(\dfrac{0.5}{n}.....0.5...............0.25\)
\(M_N=\dfrac{16.25}{\dfrac{0.5}{n}}=32.5n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow N=65\)
\(Nlà:Zn\)
Không tính được thể tích vì thiếu nồng độ mol nhé.
\(2.\)
\(n_{Al}=\dfrac{8.1}{27}=0.3\left(mol\right)\)
\(n_{HCl}=\dfrac{21.9}{36.5}=0.6\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2........0.6..........0.2...........0.3\)
\(m_{Al\left(dư\right)}=\left(0.3-0.2\right)\cdot27=2.7\left(g\right)\)
\(m_{AlCl_3}=0.2\cdot133.5=26.7\left(g\right)\)
\(CuO+H_2\underrightarrow{t^0}Cu+H_2O\)
\(0.3.....0.3\)
\(m_{CuO}=0.3\cdot80=24\left(g\right)\)

a) Gọi Kl cần tìm là X có hóa trị chưa biết là n
2X+ 2nHCl = 2XCln+ nH2
Có nH2=0,25 mol --> nX= 0,5/n mol ---> mX=0,5.MX/n=16,25 --> MX=32,5n
n=1 => MX=32,5( không có Kl nào tm)
n=2 => MX=65( Zn)
b) nHCl= 2nH2=2.0,25=0,5 mol
==> VddHCl cần = 0,5/0,2=2,5 lit

Phương trình hóa học của phản ứng:
M + n/2HCl → M Cl n
M + mHCl → M Cl m + m/2 H 2
Theo đề bài, ta có:
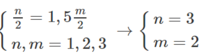
và M + 106,5 = 1,2886 (M+71)
Giải ra, ta có M = 52 (Cr)
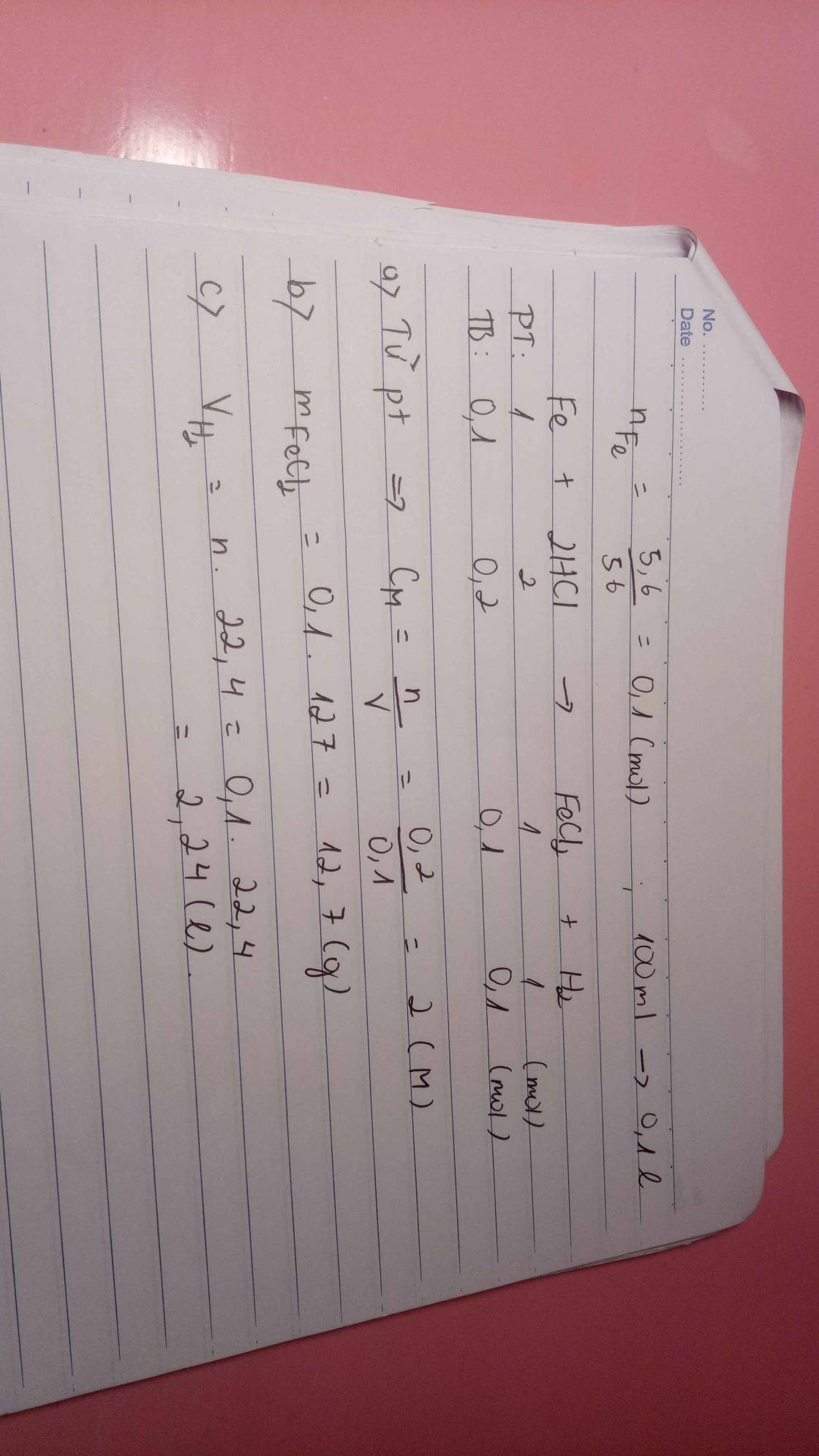
nMg=\(\frac{7,2}{24}\)=0,3 mol
Mg+2HCl\(\rightarrow\)MgCl2+H2
\(\rightarrow\) nHCl=0,6 mol
\(\rightarrow\)V HCl=\(\frac{0,6}{6}\)=0,1l=100ml