Đốt cháy 20 cm3 H2 trong 20 cm3 O2 (đktc). Tính thể tích chất dư.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a) $n_{Cu} = \dfrac{12,8}{64} = 0,2(mol)$
$n_{O_2} = \dfrac{33,6.20\%}{22,4} = 0,3(mol)$
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
$n_{Cu} : 2 < n_{O_2} :2$ nên Oxi dư
$n_{CuO} = n_{Cu} = 0,2(mol)$
$m_{CuO} = 0,2.80 = 16(gam)$
b)
$n_{O_2\ pư} = \dfrac{1}{2}n_{Cu} = 0,1(mol)$
$m_{O_2\ dư} = (0,3 - 0,1).32 = 6,4(gam)$

a)
\(n_P = \dfrac{62}{31} = 2(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ n_{O_2} = \dfrac{5}{4}n_P = 2,5(mol)\\ V_{O_2} = 2,5.22,4 = 56(lít)\\ V_{không\ khí} = \dfrac{56}{20\%} = 280(lít)\)
b)
\(n_P = \dfrac{31}{31} = 1(mol) ; n_{O_2} = \dfrac{23}{32} = 0,71875(mol)\\ \dfrac{n_P}{4} = 0,25 > \dfrac{n_{O_2}}{5} = 0,14375 \to P\ dư\\ n_{P\ pư} = \dfrac{4}{5}n_{O_2} = 0,575(mol)\\ m_{P\ dư} = 31 - 0,575.31 = 13,175(gam)\\ n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,2875(mol) \Rightarrow m_{P_2O_5} = 0,2875.142=40,825(gam)\)

a: \(4Al+3O_2\rightarrow2Al_2O_3\)
b: \(n_{Al}=\dfrac{21.6}{27}=0.8\left(mol\right)\)
\(\Leftrightarrow n_{Al_2O_3}=0.4\left(mol\right)\)
\(m_{Al_2O_3}=0.4\cdot102=40.8\left(g\right)\)
c: \(n_{O_2}=0.6\left(mol\right)\)
\(V_{O_2}=0.6\cdot22.4=13.44\left(lít\right)\)
a) 4Al + 3O2 --to--> 2Al2O3
b) \(n_{Al}=\dfrac{21,6}{27}=0,8\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,8-->0,6-------->0,4
=> \(m_{Al_2O_3}=0,4.102=40,8\left(g\right)\)
c) \(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
d) \(V_{kk}=13,44:20\%=67,2\left(l\right)\)

\(V_{O_2}=\dfrac{225.20}{100}=45\left(ml\right)\)
Vì số mol tỉ lệ thuận với thể tích. Gọi hidrocacbon cần tìm là CxHy (x,y: nguyên, dương)
\(2C_xH_y+\dfrac{4x+y}{2}O_2\rightarrow2xCO_2+yH_2O\)
Ta có:
\(30.\dfrac{4x+y}{2}=2x.45\\ \Leftrightarrow60x+15y=90x\\ \Leftrightarrow30x=15y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{15}{30}=\dfrac{1}{2}\\ CTĐGN:\left(CH_2\right)_a\)
a= 30/10=3
=> CTPT: C3H6

Đáp án C
Quan sát 4 đáp án ta có công thức của X có dạng CxHy
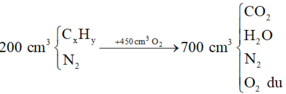
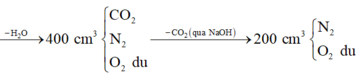
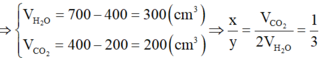
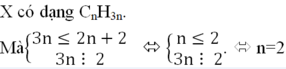
![]()

$n_{O_2} = \dfrac{1,12}{22,4}.20\% = 0,01(mol)$
$n_{CO_2} = \dfrac{244}{1000.22,4} = 0,01(mol)$
$n_{Na_2CO_3} = 0,005(mol)$
Bảo toàn khối lượng : $n_{H_2O} = \dfrac{0,74 + 0,01.32 - 0,01.44 - 0,53}{18} = 0,005(mol)$
Ta có :
$n_C = n_{CO_2} + n_{Na_2CO_3} = 0,015(mol)$
$n_H = 2n_{H_2O} = 0,01(mol)$
$n_O = 0,01.2 + 0,005.3 + 0,005 - 0,01.2 = 0,02(mol)$
$n_{Na} = 2n_{Na_2CO_3} = 0,005.2 = 0,01(mol)$
Ta có:
$n_C : n_H : n_O : n_{Na} = 0,015 : 0,01 : 0,02 : 0,01 = 3 : 2 : 4 : 2$
Vậy A có CTĐGN là $C_3H_2O_4Na_2$

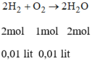
* Chú ý: cùng đktc: tỉ lệ số mol = tỉ lệ thể tích
Tỉ số mol của H 2 và O 2 :
Chọn D

\(20cm^3\) khí thoát ra là \(O_2\)
\(\Rightarrow V_{O_2\left(d\text{ư}\right)}=20\left(cm^3\right)\Rightarrow\left\{{}\begin{matrix}V_{O_2\left(p\text{ư}\right)}=70-20=50\left(cm^3\right)\\V_{CO_2}+V_{H_2O}=90-20=70\left(cm^3\right)\end{matrix}\right.\)
Đặt CTPT của hiđrocacbon là \(C_xH_y\left(x,y\in N\text{*}\right)\)
Vì các khí đo ở cùng điều kiện nên tỉ lệ thể tích cũng là tỉ lệ mol
\(\Rightarrow n_{C_xH_y}:n_{O_2}:\left(n_{CO_2}+n_{H_2O}\right)=V_{C_xH_y}:V_{O_2}:\left(V_{CO_2}+V_{H_2O}\right)=10:50:70=1:5:7\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CO_2}+n_{H_2O}=7n_{C_xH_y}\\n_{O_2}=5n_{C_xH_y}\end{matrix}\right.\)
PTHH: \(C_xH_y+\left(x+\dfrac{y}{4}\right)O_2\xrightarrow[]{t^o}xCO_2+\dfrac{y}{2}H_2O\)
\(\Rightarrow\left\{{}\begin{matrix}x+\dfrac{y}{2}=7\\x+\dfrac{y}{4}=5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=3\\y=8\end{matrix}\right.\left(TM\right)\)
Vậy CTPT của hiđrocacbon là \(C_3H_8\)

theo quy ước C hóa trị 4 .
1 nguyên tử C sẽ liên kết với 4 nguyên tử H
=> Làm gì có chất nào là CH.
CH là chất giữ ẩm nghen bạn. Thường là giữ ẩm cho cây trồng vô cái mùa hạ đó nghen