Cho 48 gam Fe2O3 vào dung dịch HNO3 12,6% vừa đủ. Tính nồng độ phần trăm dung dịch thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Mol: 0,2 0,8 0,2
\(V_{NO}=0,2.22,4=4,48\left(l\right)\)
b, \(C\%_{ddHNO_3}=\dfrac{0,8.63.100\%}{200}=25,2\%\)

a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$

$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$Fe_2O_3 + 6HNO_3 \to 2Fe(NO_3)_3 + 3H_2O$
n Fe = n NO = 1,12/22,4 = 0,05(mol)
=> n Fe2O3 = (29,6 - 0,05.56)/160 = 0,1675 mol
n HNO3 = 4n Fe + 6n Fe2O3 = 1,205(mol)
=> m dd HNO3 = 1,205.63/12,6% = 602,5 gam
Sau phản ứng :
n Fe(NO3)3 = n Fe + 2n Fe2O3 = 0,385 mol
m dd = m X + m dd HNO3 - n NO = 29,6 + 602,5 - 0,05.30 = 630,6 gam
=> C% Fe(NO3)3 = 0,385.242/630,6 .100% = 14,77%

Định hướng tư duy giải
Ta có:
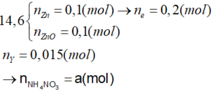
Có NH4NO3 vì nếu Y là N2
→ n e Max = 0 , 15 < 0 , 2 .
Sau khi cho KOH vào thì K nó chạy đi đâu? Việc trả lời CÂU hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
0,74 mol KOH + X
→ BTNT . K n K N O 3 = 0 , 74 - 0 , 14 . 2 = 0 , 46 m o l n K 2 Z n O 2 = 0 , 2 - 0 , 06 = 0 , 14 m o l
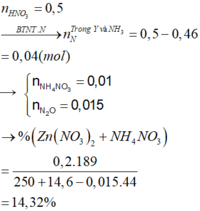

Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C

Chọn đáp án D
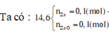


Có NH4NO3 vì nếu Y là N2 ![]()
Sau khi cho KOH vào thì K nó chạy đi đâu?Việc trả lời câu hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
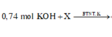

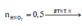
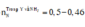
![]()
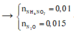
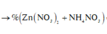
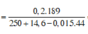
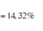

1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
nH2=13,44/22,4=0,6(mol)
Đặt: nMg=a(mol); nAl=b(mol) (a,b>0)
1) PTHH: Mg + H2SO4 -> MgSO4 + H2
a__________a________a_____a(mol)
2Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
b___1,5b______0,5b____1,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+27b=12,6\\a+1,5b=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
=> mMg=0,3.24=7,2(g)
=>%mMg= (7,2/12,6).100=57,143%
=>%mAl=42,857%
2) mMgSO4=120.a=120.0,3=36(g)
mAl2(SO4)3=342.0,5b=342.0,5.0,2= 34,2(g)
mH2SO4= (0,3+0,2.1,5).98=58,8(g)
=>mddH2SO4=58,8: 14,7%=400(g)
=>mddsau= 12,6+400 - 2.0,6= 411,4(g)
=>C%ddAl2(SO4)3= (34,2/411,4).100=8,313%
C%ddMgSO4=(36/411,4).100=8,751%
Ta có: \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
PTHH: Fe2O3 + 6HNO3 ---> 2Fe(NO3)3 + 3H2O
Theo PT: \(n_{HNO_3}=6.n_{Fe_2O_3}=6.0,3=1,8\left(mol\right)\)
=> \(m_{HNO_3}=1,8.63=133,4\left(g\right)\)
Ta có: \(\dfrac{133,4}{m_{dd_{HNO_3}}}.100\%=12,6\%\)
=> \(m_{dd_{HNO_3}}\approx1059\left(g\right)\)
=> \(m_{dd_{Fe\left(NO_3\right)_3}}=48+1059=1107\left(g\right)\)
Theo PT: \(n_{Fe\left(NO_3\right)_3}=2.n_{Fe_2O_3}=2.0,3=0,6\left(mol\right)\)
=> \(m_{Fe\left(NO_3\right)_3}=0,6.242=145,2\left(g\right)\)
=> \(C\%_{Fe\left(NO_3\right)_3}=\dfrac{145,2}{1107}.100\%\approx13,12\%\)