Cho 32,8g Na3PO4 tác dụng với 51g AgNO3. Tính klg các chất còn lại sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: Na3PO4 + 3AgNO3 ==> 3NaNO3 + Ag3PO4 \(\downarrow\)
Ta có: \(\left\{\begin{matrix}n_{Na3PO4}=\frac{32,8}{164}=0,2\left(mol\right)\\n_{AgNO3}=\frac{51}{170}=0,3\left(mol\right)\end{matrix}\right.\)
Lập tỉ lệ: \(\frac{0,2}{1}>\frac{0,3}{3}\)
=> Na3PO4 dư, AgNO3 hết
=> Tính theo số mol của AgNO3
=> Các chất còn lại sau phản ứng là Ag3PO4, NaNO3, Na3PO4(dư)
Gợi ý phần tiếp theo:(phần này dễ)
- Đã chứng minh được AgNO3 hết, dựa vào số mol AgNO3 tính được số mol các chất còn lại
- Tính khối lượng
=> Bài toán đã xong!
\(n_{Na_3PO_4}=\frac{32,8}{164}=0,2\left(mol\right)\)
\(n_{AgNO_3}=\frac{51}{170}=0,3\left(mol\right)\)
Ta có phương trình:
Na3PO4 + 3AgNO3 -> 3NaNO3 + Ag3PO4 \(\downarrow\)
B.đầu 0,2 0,3 0 0
P.ứng 0,1 0,3 0,3 0,1
Sau p.ứng 0,1 0 0,3 0,1
=> mNaNO3 = 0,3.85 = 25,5 (g)
=> mAg3PO4 = 0,1.419 = 41,19 (g)
=> mNa3PO4(dư) = 0,1.164 = 16,4(g)

Fe(NO3)2 tác dụng với dung dịch HCl theo phương trình sau:
![]()
![]()
![]()
![]()
NaF tác dụng với dung dịch HCl theo phương trình sau:
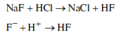
NaOH tác dụng với dung dịch HCl theo phương trình sau:
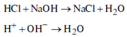
FeCl2 không có phản ứng với dung dịch HCl.
Na3PO4 tác dụng với dung dịch HCl theo phương trình sau:
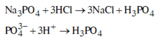
CuSO4 thì không phản ứng với dung dịch HCl.
AgNO3 tác dụng với dung dịch HCl theo phương trình sau:
![]()
Các chất phản ứng với dung dịch HCl gồm Fe(NO3)2, NaF, NaOH, Na3PO4, AgNO3.
Đáp án D

Tk
2Ca + O2 -> 2CaO (1)
CaO + 2HCl -> CaCl2 + H2O (2)
nCa=0,4(mol)
nHCl=0,5(mol)
Từ 1:
nCaO=nCa=0,4(mol)
Vì 0,4>0,52=0,250,4>0,52=0,25 nên sau PƯ 2 thì CaO dư 0,15 mol
Từ 2:
nCaCl2=1212nHCl=0,25(mol)
mCaCl2=111.0,25=27,75(g)
mCaO=56.0,15=8,4(g)

\(n_{Ca}=\dfrac{8}{40}=0,2mol\\ 2Ca+O_2\xrightarrow[]{t^0}2CaO\\ n_{CaO}=n_{Ca}=0,2mol\\ n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\\ CaO+2HCl\rightarrow CaCl_2+H_2O\\ \Rightarrow\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCl.dư\\ n_{CaCl_2}=n_{CaO}=0,2mol\\ n_{HCl}=2n_{CaO}=0,4mol\\ m_{CaCl_2}=0,2.111=22,2g\\ m_{HCl.dư}=\left(0,5-0,4\right).36,5=3,65g\)

A) nZn=0,1(mol); nS=0,2(mol)
PTHH: Zn + S -to-> ZnS
Ta có: 0,2/1 > 0,1/1
=> Zn hết, S dư, tính theo nZnS
=> nZnS= nS(p.ứ)=nZn=0,1(mol)
=> nS(dư)=0,2-0,1=0,1(mol)
=>mS(dư)=0,1.32=3,2(g)
b) mZnS=0,1.81=8,1(g)

Zn+S->ZnS
0,2-------0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
n S=\(\dfrac{9,6}{32}\)=0,3 mol
=>S dư
=>m S=0,1.32=3,2g
=>m ZnS=0,2.97=19,4g
\(n_{Na_3PO_4}=\dfrac{32,8}{164}=0,2mol\)
\(n_{AgNO_3}=\dfrac{51}{170}=0,3mol\)
Na3PO4+3AgNO3\(\rightarrow\)3NaNO3+Ag3PO4
Tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\rightarrow Na_3PO_4dư\), AgNO3 hết
\(n_{NaNO_3}=n_{AgNO_3}=0,3mol\rightarrow m_{NaNO_3}=0,3.85=25,5gam\)
\(n_{Ag_3PO_4}=\dfrac{1}{3}n_{AgNO_3}=0,1mol\rightarrow m_{Ag_3PO_4}=419.0,1=41,9gam\)
\(n_{Na_3PO_4}=\dfrac{1}{3}n_{AgNO_3}=0,1mol\rightarrow n_{Na_3PO_4\left(dư\right)}=0,2-0,1=0,1mol\)
\(m_{Na_3PO_4}=0,1.164=16,4gam\)