Cho m gam BaCl2 vào lượng dư dung dịch H2SO4 , thu được 34,95 g kết tủa . Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
Hỗn hợp 2 khí gồm CO2 và NO2 ( MZ = 45,858g) ( S -> SO4)
nKOH = 1,6 mol
nkết tủa = nBaSO4 = 0,15 mol = nS
C + 4HNO3 -> CO2 + 2H2O + 4NO2
.x -> x -> 4x
S + 6HNO3 -> H2SO4 + 6NO2 + 2H2O
0,15 -> 0,9
=> áp dụng qui tắc đường chéo : nNO2 : nCO2 = 929/71 = (0,9 + 4x) / x
=> x = 0,1 mol
=> m = mC + mS = 6g
2NO2 + 2KOH -> KNO2 + KNO3 + H2O
1,3 -> 1,3 mol
2KOH + CO2 -> K2CO3 + H2O
0,2 <- 0,1
Chất tan gồm 0,1 mol K2CO3 ; 0,65 mol KNO2 ; 0,65 mol KNO3 ; 0,1 mol KOH
=> m1 = 140,3g
=> m + m1 = 146,3g

Đáp án D
· Hỗn hợp 2 khí gồm NO2 (x mol) và CO2 (y mol)
⇒ 46 x + 44 y x + y = 2 . 22 , 92 = 45 , 858 ( 1 )
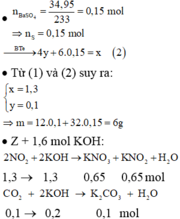
=> m = 101.0,65 + 85.0,65 + 138.0,1 + 56.(1,6-1,3-0,2) = 140,3 gam
=> m + m 1 = 146 , 3 gam

n CO 3 2 - = 0 , 15 mol ; n H + = 0 , 2 ; n SO 4 2 - = 0 , 1
Phản ứng xảy ra:
Ban đầu: 0,15 0,2
Phản ứng: 0,1 0,2 0,1
Sau phản ứng: 0,05 0 0,1
Dung dịch X chứa: 0,05 mol và 0,1 mol
Khi cho BaCl2 dư vào X:
0,05 0,05
0,1 0,1
Khối lượng kết tủa thu được sau phản ứng: m = 0,05.197+0,1.233=33,15 (gam)
Đáp án D.

Đáp án D
8,72 X C r : x m o l C r O : y m o l C r 2 O 3 : z m o l → H 2 S O 4 0 , 07 m o l H 2 + Y C r S O 4 : x + y C r ( S O 4 ) 3 : ≈ → d u N a O H ( y + x ) m o l C r ( O H ) 2 + Z N a [ C r ( O H ) 4 ] N a O H N a 2 S O 4 : x + y + 3 ≈ → + B a C l 2 + C l 2 B a C r O 4 : 2 B a S O 4 : x + y + 3
Gọi số mol của Cr, CrO, Cr2O3 lần lượt là x, y, z mol
Khi tác dụng với H2SO4 chỉ có Cr tác dụng sinh ra khí H2
Bảo toàn electron → x = nH2 = 0,07 mol
Có nCr(OH)2 = x+ y = 8,6 : 86 = 0,1 → y = 0,03 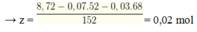
m↓ = 0,04. 253 + ( 0,07 + 0,03 + 3. 002) . 233= 47,4 gam.
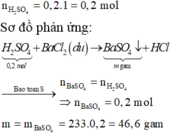

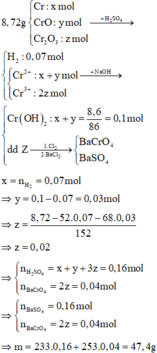
BaCl2 + H2SO4 \(\rightarrow\) BaSO4 \(\downarrow\) + 2HCl
\(n_{BaSO_4}=\dfrac{34,95}{233}=0,15\left(mol\right)\)
\(\Rightarrow n_{BaCl_2}=n_{BaSO_4}=0,15\left(mol\right)\)
\(\Rightarrow m=208\cdot0,15=31,2\left(g\right)\)
PTHH: BaCl2 + H2SO4 -> BaSO4 \(\downarrow\)+ 2HCl
- Chất kết tủa thu dc là BaSO4.
\(n_{BaSO_4}=\dfrac{34,95}{233}=0,15\left(mol\right)\\ =>n_{BaCl_2}=n_{BaSO_4}=0,15\left(mol\right)\\ =>m_{BaCl_2}=0,15.208=31,2\left(g\right)\)