hoà tan 1.92 g KL M hoá trị 2 vào 100ml dd HNO3 1M thấy thoát ra 0.488 lít NO. Xđ M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Td với H2SO4:
\(n_{H_2}=\dfrac{2,9748}{24,79}=0,12mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al}=\dfrac{0,12.2}{3}=0,08mol\)
Td với HNO3:
\(n_{Al}=a=0,08mol\\ n_{Cu}=b\)
Khí hoá nâu trong không khí → NO
\(n_{NO}=\dfrac{3,664}{24,79}=0,16mol\\ 3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\\ Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(\Rightarrow a+\dfrac{2}{3}b=0,16\\ \Leftrightarrow0,08+\dfrac{2}{3}b=0,16\\ \Leftrightarrow b=0,12mol\\ \Rightarrow m=0,08.27+0,12.64=9,84g\)

Đáp án A.
![]()
![]()
![]()

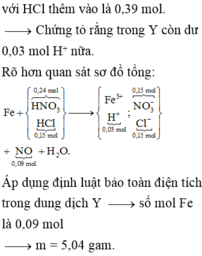
Bảo toàn e ta có: 3x = 1,2 + 6,4 + 8 = 15,6 => x =5,2 .
mAl = 5,2.27=140,4(gam).

Đáp án C
0,3 mol NaOH phản ứng với dung dịch Y: cuối cùng Natri đi về đâu?
À, trong 0,15 mol NaCl (bảo toàn Cl) và còn lại là 0,15 mol trong NaNO3.
Nhẩm nhanh ở phản ứng Fe + HNO3 → 0,006 mol NO
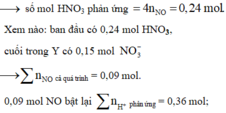
mà tổng HNO3 ban đầu với HCl thêm vào là 0,39 mol.
→ Chứng tỏ rằng trong Y còn dư 0,03 mol H+ nữa.
Rõ hơn quan sát sơ đồ tổng:
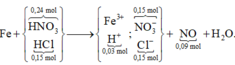
Áp dụng định luật bảo toàn điện tích trong dung dịch Y → số mol Fe là 0,09 mol
→ m = 5,04 gam.

\(a)n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\\
Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(n_{Fe_2O_3}=\dfrac{21,6-56.0,1}{160}=0,1mol\\
Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2\)
0,1 0,6 0,2 0,3
\(V_{ddHCl}=\dfrac{0,2+0,6}{1}=0,8l\\
b.C_{M_{FeCl_2}}=\dfrac{0,1}{0,8}=0,125M\\
C_{M_{FeCl_3}}=\dfrac{0,2}{0,8}=0,25M\)

Đáp án A
Quy đổi hỗn hợp thành Fe và O với số mol là x và y → 56x + 16y =17,04 g
nNO =0,015 mol → nH+(A)=0,06 mol
Bảo toàn số mol H+ có nHCl = 2nH2 +2nO + nH+(A) → nO= y=(0,66 -0,06-2.0,075):2=0,225 mol
→ x =0,24 mol
Khi cho AgNO3 vào dd A thì tạo ↓ AgCl và Ag
Bảo toàn số mol Cl thì AgCl : 0,66 mol
Bảo toàn e cho toàn bộ quá trình thì 3x =2.0,075 + 2.0,225 +3.0,015+ nAg→ nAg=0,075 mol
→ m =0,075.108 +0,66 .143,5=102,81 g

nHCl = CM.V = \(\dfrac{100}{1000}.3\) = 0,3 mol
PTPỨ: 2M + 6HCl -> MCl3 + 3H2
2 6
x 0,3
\(\Rightarrow x=n_M=\dfrac{0,3.2}{6}=0,1\) mol
\(M_M=\dfrac{m}{n}=\dfrac{2,7}{0,1}=27\) (Al)
Vậy kim loại M là Al
\(2M+6HCl\rightarrow2MCl_3+3H_2\uparrow\)
0,1 0,3
\(n_{HCl}=C_M.V=0,1.3=0,3\left(mol\right)\)
\(M_M=\dfrac{m}{n}=\dfrac{2,7}{0,1}=27\left(\dfrac{g}{mol}\right)\)
---> Zn