Một loại khoáng có chứa 13.77%Na; 7.18% Mg; 57.48%O; 2.39% H và còn lại là nguyên tố X, Xác định của khoáng đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi nguyên tố cuối cùng là X.
Đặt công thức phân tử là Nax.Mgy.Oz.Ht.Xu
Ta có x : y : z : t : u = (13,77/23) : (7,18/24) : (57,48/16) : (2,39/1) : (19,18/MX) = 2 : 1 : 12 : 8 : (64/MX)
Vì x, y, z, t, u là những số nguyên nên 64/MX phải là số nguyên.
Phân tích 64 ra thừa số nguyên tố ta có: 64 = 2 x 2 x 2 x 2 x 2 x 2 nên MX có thể là:
2 với u = 32 (loại)
4 với u = 16 (loại)
8 với u = 8 (loại)
16 với u = 4 --> X là O --> (loại)
32 với u = 2 --> X là S.
64 với u = 1 --> X là Cu.
Vậy, khoáng vật có thể là
Na2MgO12H8S2: Na2SO4.MgSO4.4H2O

Với 32 000 đồng bạn Na mua được :
32 000 : 15 000 = 2 ( chai ) và thừa 32 000 - 15 000.2 = 2 000 ( đồng )
Vậy bạn Na không đủ tiền để mua 3 chai nước khoáng
* Chú ý : Để mua được 3 chai mà không thừa tiền gì, bạn Na cần có :
15 000.3 = 45 000 ( đồng )

Đáp án B
Vì mẫu nước này không chứa ion Ca2+ và ion Mg2+ nên nó thuộc loại nước mềm.
Sai lầm thường gặp : Chỉ chú ý đến các anion và chọn đáp án A.
Hàm lượng :
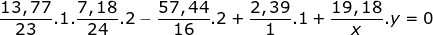
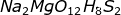
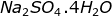
%X = 100% - 13.77% - 7.18% - 57.48% - 2.39% = 19.38%
Cân bằng số oxi hóa trong hợp chất:
⇒X = 5.33 y
A=A+1:5,33.A
(Ở đây A có vai trò của y)
Sau đó ấn =...= đến khi A=6
ta được kết quả tích gần bằng 32
Vậy X là S (lưu huỳnh)
và
Na: Mg: O:H:S=2:1:12:8:2
Công thức khoáng:
hay
ko dùng máy tính được ko bạn, cách khác ý