Cho 2,4g Mg tác dụng với dung dịch HCl 20% . Tính nồng độ % sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b. \(n_{Mg}=\dfrac{2.4}{24}=0.1mol\)
\(mct_{HCl}=\dfrac{500\times36.5}{100}=182.5g\Rightarrow n_{HCl}=\dfrac{182.5}{36.5}=5mol\)
Ta có: \(\dfrac{0.1}{1}< \dfrac{5}{2}\Rightarrow\) HCl dư
nHCl phản ứng = 0.2 mol => nHCl dư = 5 - 0.2 = 4.8 mol
mHCl dư = \(4.8\times36.5=175.2g\)
c. \(V_{H_2}=0.1\times22.4=2.24l\)
d. mdd sau phản ứng = \(2.4+500-0.1\times2=502.2g\)
\(C\%_{MgCl_2}=\dfrac{0.1\times95\times100}{502.2}=1.89\%\)

Mg+2HCl->MgCl2+H2
0,1---0,2-----0,1-----0,1
n Mg=0,1 mol
=>VH2=0,1.22,4=2,24l
C% HCl dư=\(\dfrac{0,2.36,5}{100}100\)=7,3%
=>C%MgCl2=\(\dfrac{0,1.95}{2,4+100-0,1.2}100=9,29\%\)

a) \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
_____0,1<-0,2------<0,1<---0,1
=> mMgCl2 = 0,1.95 = 9,5 (g)
b) \(C_{M\left(HCl\right)}=\dfrac{0,2}{0,2}=1M\)

a, \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
b, \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{MgSO_4}=n_{H_2}=n_{Mg}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.24,79=2,479\left(l\right)\)
c, \(m_{ddH_2SO_4}=\dfrac{0,1.98}{19,6\%}=50\left(g\right)\)
d, Ta có: m dd sau pư = 2,4 + 50 - 0,1.2 = 52,2 (g)
\(\Rightarrow C\%_{MgSO_4}=\dfrac{0,1.120}{52,2}.100\%\approx22,99\%\)

\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(V_{H_2SO_4}=20ml=0,02\left(l\right)\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
0,1--->0,1----------->0,1------>0,1
\(CM=\dfrac{n}{V}=\dfrac{0,1}{0,02}=5M\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)

\(n_{H_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(\dfrac{0.2}{n}.......................0.1\)
\(M_A=\dfrac{2.4}{\dfrac{0.2}{n}}=12n\left(\dfrac{g}{mol}\right)\)
\(BL:n=2\Rightarrow M=24\)
\(A:Mg\)
\(m_{MgCl_2}=0.1\cdot95=9.5\left(g\right)\)
\(m_{ddHCl}=\dfrac{0.2\cdot36.5}{7.3\%}=100\left(g\right)\)
\(m_{dd}=2.4+100-0.1\cdot2=102.2\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{9.5}{102.2}\cdot100\%=9.3\%\)

Bài 1 :
PTHH : Zn + H2SO4 ------> ZnSO4 + H2
\(n_{Zn}=\frac{m}{M}=\frac{26}{65}=0,4\left(mol\right)\)
Theo PTHH : nH2 = nZn = 0,4 mol
=> Khối lượng H2 được tạo ra ở đktc là :
\(V=n\times22,4\)
\(\Rightarrow V_{H_2}=0,4\times22,4\)
\(\Rightarrow V_{H_2}=8,96\left(l\right)\)
Theo PTHH : nZnSO4 = nZn = 0,4 mol
=> Khối lượng muối được tạo thành là :
\(m=n\times M\)
\(\Rightarrow m_{ZnSO_4}=0,4\times161\)
\(\Rightarrow m_{ZnSO_4}=64,4\left(g\right)\)
b) Theo PT : \(n_{H_2SO_4}=n_{Zn}=0,4\left(mol\right)\)
=> Khối lượng \(H_2SO_4\)cần dùng cho phản ứng là :
\(m=n\times M\)
\(\Rightarrow m_{H_2SO_4}=0,4\times98\)
\(\Rightarrow m_{H_2SO_4}=39,2\left(g\right)\)
c) Nồng độ phần trăm thu được sau phản ứng là :
\(C\%=\frac{m_{ct}}{m_{dd}}\times100\%\)
\(\Rightarrow C\%=\frac{39,2}{64,4}\times100\%\approx60,9\%\)
Vậy :.........................
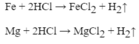

\(n_{Mg}=\frac{2,4}{24}=0,1\left(mol\right)\)
\(Mg+2HCl->MgCl_2+H_2\left(1\right)\)
theo (1) \(n_{MgCl_2}=n_{Mg}=0,1\left(mol\right)\) => \(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
theo (1) \(n_{HCl}=2n_{Mg}=0,2\left(mol\right)\) => \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
=> khối lượng dung dịch HCl là : 7,3 : 20% = 36,5 (g)
theo (1) \(n_{H_2}=n_{Mg}=0,1\left(mol\right)\) => \(m_{H_2}=0,1.2=0,2\left(g\right)\)
khối lượng dung dịch sau phản ứng là
\(2,4+36,5-0,2=38,7\left(g\right)\)
nồng độ % dung dịch sau phản ứng là \(\frac{9,5}{38,7}.100\%=24,55\%\)
\(n_{Mg}=\frac{2,4}{24}=0,1\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 mol 0,2mol 0,1 mol 0,1 mol \(m_{MgCl_2}=0,1.95=9,5\left(g\right)\)
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Khối lượng dung dịch HCl là:
\(m_{d_2}=\frac{7,3}{20\%}=36,5\left(g\right)\)
Khối lượng dung dịch sau phản úng là
\(m_{d_2}=2,4+36,5-0,1.2=38,7\left(g\right)\)
\(C\%=\frac{9,5}{38,7}.100\%=24,55\%\)