phân loại các chất sau: O2,SO2,CO2,CO,H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Dùng quỳ tím ẩm
- Hóa đỏ: HCl
- Hóa đỏ rồi mất màu: Clo
- Không đổi màu: Oxi
b) Dùng quỳ tím
- Hóa đỏ: CO2
- Hóa đỏ rồi mất màu: Clo
- Không hiện tượng: CO
c)
- Dùng quỳ tím ẩm
+) Hóa xanh: NH3
+) Không đổi màu: Oxi
+) Hóa đỏ: CO2 và SO2
- Sục 2 khí còn lại qua dd Brom
+) Dung dịch Brom nhạt màu: SO2
PTHH: \(SO_2+Br_2+2H_2O\rightarrow H_2SO_4+2HBr\)
+) Không hiện tượng: CO2

a, Cho thử que đóm còn đang cháy:
- Cháy mãnh liệt -> O2
- Cháy màu xanh nhạt -> H2
- Vụt tắt -> NH3, CO2 (1)
Dẫn (1) qua dd Ca(OH)2 dư:
- Có kết tủa trắng -> CO2
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
- Ko hiện tượng -> NH3
b, Dẫn qua Fe2O3 nung nóng:
- Làm chất rắn màu đỏ nâu chuyển dần sang màu trắng xám Fe -> CO
\(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\uparrow\)
- Ko hiện tượng -> SO2, N2 (1)
Dẫn (1) qua dd Br2 dư:
- Làm Br2 mất màu -> SO2
\(SO_2+2H_2O+Br_2\rightarrow H_2SO_4+2HBr\)
- Không hiện tượng -> N2
a. H2, NH3, O2 và khí CO2
Nhận biết CO2: suc qua nước vôi trong tạo kết tủa trắng:
CO2 + Ca(OH)2→ CaCO3 + H2O
– Nhận biết H2: cháy trong CuO nung nóng thì làm CuO chuyển sang màu đỏ
CuO + H2 → Cu + H2O
– Nhận biết NH3 và O2:
– Dùng tàn đóm que diêm: O2 làm bùng cháy que đóm.
– Còn lại là NH3 có mùi hắc (
b, SO2, CO và khí N2
Dẫn các khí qua brom dư. SO2 làm mất màu brom.
SO2+ Br2+ 2H2O -> 2HBr+ H2SO4
Dẫn các khí còn lại qua nước vôi trong dư. CO2 làm đục nước vôi.
CO2+ Ca(OH)2 -> CaCO3+ H2O
Đốt 2 khí còn lại. Khí cháy là CO. N2 không cháy.
2CO+ O2 (t*)-> 2CO2

Câu 1.
a)\(3H_2+Fe_2O_3\rightarrow2Fe+3H_2O\)
b)\(4H_2+Fe_3O_4\rightarrow3Fe+4H_2O\)
c)\(2H_2+O_2\underrightarrow{550^oC}2H_2O\)
d)\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
e)\(3O_2+4Al\underrightarrow{t^o}2Al_2O_3\)
Câu 2.
\(CuO:\) oxit bazo có tên đồng (ll) oxit
\(Na_2O:\) oxit bazo có tên natri oxit
\(FeO:\) oxit bazo có tên sắt (ll) oxit
\(SO_2:\) oxit axit có tên lưu huỳnh đioxit
\(SO_3:\) oxit axit có tên lưu huỳnh trioxit
\(CO_2:\) oxit axit có tên cacbon đioxit
\(P_2O_5:\) oxit axit có tên điphotphopentaoxit


* Trích một ít các chất làm mẫu thử
a) Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: NaCl
b)
- Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl, H2SO4 (1)
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: NaCl, Na2SO4 (2)
- Cho dd Ba(OH)2 tác dụng với dd ở (1)
+ Không hiện tượng: HCl
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
+ Kết tủa trắng: H2SO4
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
- Cho dd Ba(OH)2 tác dụng với dd ở (2)
+ Không hiện tượng: NaCl
+ Kết tủa trắng: Na2SO4
\(Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\downarrow\)
c)
- Dẫn các khí đi qua dd Ca(OH)2 dư
+ Kết tủa trắng: CO2
+ Không hiện tượng: O2, H2 (1)
- Cho các khí ở (1) tiếp xúc với que đóm còn tàn đỏ
+ Que đóm bùng cháy: O2
+ Que đóm tắt: H2
d)
- Dẫn các khí đi qua dd Br2 dư
+ Dung dịch nhạt màu dần: SO2
\(SO_2+Br_2+2H_2O\rightarrow2HBr+H_2SO_4\)
+ Không hiện tượng: O2, H2, N2 (1)
- Cho các khí ở (1) tiếp xúc với que đóm còn tàn đỏ
+ Que đóm bùng cháy: O2
+ Que đóm tắt: H2, N2 (2)
- Dẫn các khí ở (2) đi qua bột CuO nung nóng:
+ Không hiện tượng: N2
+ Chất rắn màu đen dần chuyển sang màu đỏ: H2
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
e)
- Hòa tan 3 chất rắn vào nước:
+ Chất rắn không tan: CaCO3
+ Chất rắn tan: CaO, P2O5
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
- Cho dd thu được ở trên tác dụng với quỳ tím
+ QT chuyển đỏ: H3PO4 => Nhận biết được P2O5
+ QT chuyển xanh: Ca(OH)2 => Nhận biết được CaO
f)
- Hòa tan 3 kim loại vào nước:
+ Kim loại tan, có khí thoát ra: Na
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
+ Kim loại không tan: Mg, Fe (1)
- Cho 2 kim loại ở (1) tác dụng với dd HNO3 đặc nguội
+ Kim loại tan, có khí màu nâu thoát ra: Mg
\(Mg+4HNO_3\rightarrow Mg\left(NO_3\right)_2+2NO_2+2H_2O\)
+ Kim loại không tan: Fe
a) Trích mẫu thử. Dùng quỳ tím để thử.
dung dịch làm quỳ tím hoá đỏ --> HCl
dung dịch làm quỳ tím hoá xanh --> Ba(OH)2
dung dịch làm quỳ tím không đổi màu --> NaCl
b) Trích mẫu thử. dùng quỳ tím để thử.
dung dịch làm quỳ tím hoá xanh --> Ba(OH)2
dung dịch làm quỳ tím hoá đỏ --> HCl và H2SO4
Cho 2 dung dịch này tác dụng với BaCl2.
- Có kết tủa --> H2SO4
Pthh: BaCl2 + H2SO4 --> BaSO4 + 2HCl
- không có phản ứng --> HCl
Cho 2 dung dịch còn lại là NaCl và Na2SO4 tác dụng với BaCl2
- có kết tủa --> Na2SO4
Pthh: BaCl2 + Na2SO4 --> BaSO4 + 2NaCl
c) Đốt từng khí. Cháy lửa xanh --> H2
Dẫn 2 khí còn lại qua Ca(OH)2
- có kết tủa --> CO2
Pthh: CO2 + Ca(OH)2 --> CaCO3 + H2O
- không có hiện tượng --> O2

Nhận biết rắn
| P2O5 | Na | NaCl | CaO | MgO | |
| Nước | Tan, tạo thành dd | Tan, tạo thành dd, có sủi bọt khí | Tan, tạo thành dung dịch | Tan, tạo thành dung dịch | Không tan |
| Quỳ tím | Hoá đỏ | Đã nhận biết | Không đổi màu | Hoá xanh | Đã nhận biết |
\(2Na+2H_2O\rightarrow2NaOH+H_2\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Nbiet chất khí
| SO2 | H2 | O2 | CO2 | |
| Nước brom | Làm mất màu | Không ht | Không ht | Không ht |
| CuO/to | Đã nhận biết | Có rắn đỏ gạch và hơi nước | Không ht | Không ht |
| dd Ca(OH)2 | Đã nhận biết | Đã nhận biết | Không ht | Có kết tủa trắng |
\(SO_2+Br_2+2H_2O\rightarrow2HBr+H_2SO_4\\ CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\\ Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\left(\downarrow trắng\right)+H_2O\)

\(a.M_{H_2}=2\left(g/mol\right)\\ M_{CH_4}=16\left(g/mol\right)\\ M_{SO_2}=64\left(g/mol\right)\\ M_{CO}=28\left(g/mol\right)\\ M_{NO_2}=46\left(g/mol\right)\\ M_{Cl_2}=71\left(g/mol\right)\\ M_{CO_2}=44\left(g/mol\right)\\ \Rightarrow Cl_2nặngnhất\)
b. Trong phòng thí nghiệm,\(H_2,CH_4,CO\) được thu theo phương pháp đặt ngược bình vì các khí này nhẹ hơn không khí
c.\(d_{O_2/H_2}=\dfrac{32}{2}=16\left(lần\right)\)
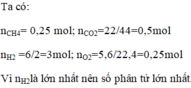
Dẫn qua nước Brom dư: SO2 phản ứng
Do que đóm còn tàn đỏ: O2 làm que đóm bùng cháy
Dẫn hỗn hợp khí còn lại qua CuO nung nóng: H2 tạo hơi nước còn CO thì không, CO và H2 làm chất rắn trong bình chuyển từ đen sang đỏ nhưng CO2 không
PTHH:
SO2 + Br2 + H2O \(\rightarrow\) HBr + H2SO4
CO + CuO \(\underrightarrow{t^o}\) Cu + CO2
H2 + CuO \(\underrightarrow{t^o}\) Cu + H2O