kể tên các chất hóa học quang trọng được sử dụng nhiều tronh bản tuần hoàn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nguyên tử của nguyên tố ở ô số 6:
- KHHH: C
- Tên nguyên tố: Carbon
- Số hiệu nguyên tử: 6
- Khối lượng nguyên tử: 12
- Số e nguyên tử: 6
---
Nguyên tử của nguyên tố ở ô số 11:
- KHHH: Na
- Tên nguyên tố: Sodium
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: 23
- Số e nguyên tử: 11

loại sản phẩm hoá học được sử dụng nhiều trong sản xuất nông nghiệp hoặc thủ công nghiệp:
+ phân bón hoá học : VD phân NPK , phân Kali, Phan lân , đạm ,..
+thuốc trừ sâu , thuốc diệt cỏ,..
+ chất nhuộm trong công nghiệp dệt vải ...

BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Sơ lược về sự phát minh ra bảng tuần hoàn: Thời Trung cổ, loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân và lưu huỳnh. Năm 1649, loài người tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Năm 1817, Đô-be-rai-nơ (J.Dobereiner) nhận thấy khối lượng nguyên tử của stronti ở giữa khối lượng nguyên tử của hai nguyên tố bari và canxi. Bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau. Tiếp theo, các nhà khoa học đã tìm ra các bộ ba khác có quy luật tương tự.
Năm 1862, nhà địa chất Pháp Đờ Săng - cuốc - toa (De Chancourtoi) đã sắp xếp các nguyên tố hoá học theo chiều tăng của khối lượng nguyên tử lên một băng giấy (băng giấy này được cuốn quanh hình trụ theo hình lò xo xoắn). Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, Giôn Niu-lan (John Newlands), nhà hoá học Anh, đã tìm ra quy luật: Mỗi nguyên tố hoá học đều thể hiện tính chất tương tự như nguyên tố thứ 8 khi xếp các nguyên tố theo khối lượng nguyên tử tăng dần.
Năm 1860, nhà bác học người Nga Men-đê-lê-ép đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hoá học. Năm 1869, ông công bố bản "bảng tuần hoàn các nguyên tố hoá học" đầu tiên. Năm 1870, nhà khoa học người Đức Lô-tha Mây-ơ (Lothar Mayer) nghiên cứu độc lập cũng đã đưa ra một bảng tuần hoàn các nguyên tố hoá học tương tự như bảng của Men-đê-lê-ép.
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Ngày nay, dưới ánh sáng của thuyết cấu tạo nguyên tử, các nguyên tố hoá học được sắp xếp trong bảng tuần hoàn theo các nguyên tắc:
1. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp thành một hàng.
3. Các nguyên tố có cùng số electron hoá trị(1) trong nguyên tử trên được gọi là bảng tuần hoàn các nguyên tố hoá học (gọi tắt là bảng tuần hoàn).
Click ở đây để xem minh họa bảng tuần hoàn
II. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
1. Ô nguyên tố
Mỗi nguyên tố hoá học được xếp vào một ô của hàng, gọi là ô nguyên tố. Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
Thí dụ: (Al) chiếm ô 13 trong bảng tuần hoàn, vậy số hiệu nguyên tử của nguyên tố Al là 13, số đối với điện tích hạt nhân là 13, hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 electron.
2. Chu kì
Chu kì dãy các nguyên tố mà nguyên tử của chúng có cùng số electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Chu kì thường bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1 và chu kì 7).
Bảng tuần hoàn gồm 7 chu kì. Các chu kì được đánh số từ 1 đến 7.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Chu kì 1 gồm 2 nguyên tố là H (Z = 1), 1s1 và He (Z = 2), 1s2.
Nguyên tử của hai nguyên tố này chỉ có 1 lớp electron, đó là lớp K.
Chu kì 2 gồm 8 nguyên tố, bắt đầu là Li (Z = 3), 1s22s1 và kết thúc là Ne (Z = 10), 1s22s22p6.
Nguyên tử của các nguyên tố này có 2 lớp electron: lớp K (gồm 2 electron) và lớp L. Số electron của lớp L tăng dần từ 1 ở liti đến tối đa là 8 ở neon (lớp electron ngoài cùng bão hoà).
Chu kì 3 gồm 8 nguyên tố, bắt đầu từ Na (Z = 11), 1s22s22p63s1 và kết thúc là Ar (Z = 18), 1s22s22p63s23p6. Nguyên tử của các nguyên tố này có 3 lớp electron: lớp K (2 electron), lớp L (8 electron) và lớp M (8 electron). Số electron của lớp M tăng dần từ 1 ở natri đến tối đa là 8 ở agon (lớp electron ngoài cùng bền vững). Bảng dưới đây cho biết số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 2 và 3.
Chu kì 2 | Li | Be | B | C | N | O | F | Ne |
Chu kì 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
Số electron ở lớp ngoài cùng | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Chu kì 4 và chu kì 5: Mỗi chu kì đều có 18 nguyên tố, bắt đầu là một kim loại kiềm (K (Z = 19): [Ar]4s1 và Rb (Z = 37): [Kr]5s1), kết thúc là một khí hiếm (Kr (Z = 36): [Ar]3d104s24p6 và Xe (Z = 54): [Kr]4d105s25p6).
Chu kì 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs (Z = 55), [Xe]6s1 và kết thúc là khí hiếm Rn (Z = 86), [Xe]4f145d106s26p6.
Chu kì 7: Chưa hoàn thành (Chu kỳ dở dang).
Các chu kì 1, 2, 3 được gọi là các chu kì nhỏ.
Các chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6 (được gọi là các nguyên tố thuộc họ lantan) và 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7 (gọi là các nguyên tố họ actini) có cấu hình electron đặc biệt, được xếp thành hai hàng ở phần cuối bảng. Như vậy, nếu trừ 14 nguyên tố trên, chu kì 6 cũng còn 18 nguyên tố như các chu kì 4 và 5, chu kì 7 còn 10 nguyên tố.
3. Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn (xem Bảng tuần hoàn). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hoá trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Ngoài cách chia các nguyên tố người ta còn chia chúng thành các khối như sau:
Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA (được gọi là nhóm kim loại kiềm) và nhóm IIA (được gọi là nhóm kim loại kiềm thổ). Thí dụ:
Na (Z = 11): 1s22s22p63s1; Mg (Z = 12): 1s22s22p63s2;
Các nguyên tố s hoạt động hoá học rất mạnh, còn được gọi là các kim loại hoạt động. Chúng có khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn hầu hết các kim loại khác.
Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ He).
Thí dụ:
O (Z = 8): 1s22s22p4; Ne (Z = 10): 1s22s22p6;
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B.
Khối nguyên tố f gồm các nguyên tố xếp ở hai hàng cuối bảng.
Nhóm B bao gồm các nguyên tố d và nguyên tố f.
Tư liệu
ĐÔI NÉT VỀ ĐI-MI-TRI-VA-NO-VÍCH MEN-ĐÊ-LÊ-ÉP
VÀ ĐỊNH LUẬT TUẦN HOÀN - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Đi-mi-tri I-va-no-vích Men-đê-lê-ép sinh ngày 27 tháng 1 năm 1934 ở thành phố To-bon (Tobonxk), trong một gia đình có 17 người con, bố là hiệu trưởng trường trung học To-bon. Sau khi tốt nghiệp Trường Trung học To-bon, ông vào học tại Trường Đại học Sư phạm Pê-téc-bua và năm 1855, khi tốt nghiệp, ông đã được nhận huy chương vàng. Trong hai năm 1859, 1860 Men-đê-lê-ép làm việc ở Đức. Sau đó, ông trở về nước Nga và được bổ nhiệm là giáo sư của Trường Đại học Kĩ thuật Pe-téc-bua. Hai năm sau, ông được bổ nhiệm là giáo sư của Trường Đại học Tổng hợp Pê-téc-bua. Sau...

Dùng kính hiển vi để quan sát vật rất nhỏ như hồng cầu

Thức ăn, đồ uống không có lợi nếu thường xuyên sử dụng nhiều đối với các cơ quan tiêu hóa, tuần hoàn, thần kinh là: lạp xưởng, đồ uống có gas, thịt xiên nướng, chân giò muối, gà rán, bánh kẹo ngọt, khoai tây chiên, hamburger.

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X- Hợp chất Y là MX
Theo giả thiết ta có:
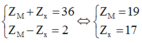
=> M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
=> Cl thuộc chu kì 3; nhóm VIIA

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X-
⇒ Hợp chất Y là MX
Theo giả thiết ta có:

⇒ M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
⇒ K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
⇒ Cl thuộc chu kì 3; nhóm VIIA

câu 6: Các thể cơ bản của chất: chất rắn, chất lỏng, chất khí.
tính chất thể rắn: chất rắn có khối lượng, hình dạng và thể tích xác định
tính chất thể lỏng: chất lỏng có khối lượng xác định, không có hình dạng xác định mà có hình dạng của vật chứ nó. chất lỏng dễ chảy.
tính chất thể khí: chất khí có khối lượng xác định nhưng không có hình dạng và thể tích xác định. chất khí có thể lan tỏa theo mọi hướng và chiếm toàn bộ thể tíchcủa bất kì vật nào chứa nó
câu 6: Các thể cơ bản của chất: chất rắn, chất lỏng, chất khí.
tính chất thể rắn: chất rắn có khối lượng, hình dạng và thể tích xác định
tính chất thể lỏng: chất lỏng có khối lượng xác định, không có hình dạng xác định mà có hình dạng của vật chứ nó. chất lỏng dễ chảy.
tính chất thể khí: chất khí có khối lượng xác định nhưng không có hình dạng và thể tích xác định. chất khí có thể lan tỏa theo mọi hướng và chiếm toàn bộ thể tíchcủa bất kì vật nào chứa nó
câu 7 : chất lỏng, khí

Oxygen, Hydrogen, Nitrogen, Carbon, Sodium (Natri), Chlorine (Clo), Felium (sắt), Sunfua (Lưu huỳnh), Alum (nhôm),....