Cho tam giác $ABC$ vuông tại $A$ có $\hat{B}=50^{\circ}$. Trên $BC$ lấy điểm $H$ sao cho $HB=BA$, từ $H$ kẻ $HE$ vuông góc với $BC$ tạ $H,(E$ thuộc $AC)$
a) Tính $\widehat{C}$.
b) Chứng minh $BE$ là tia phân giác góc $B$.
c) Gọi $K$ là giao điểm của $BA$ và $HE$, $BE$ cắt $KC$ tại $I$. Chứng minh rằng $I$ là trung điểm của $KC$.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\frac{8}{25}giờ+\) \(14,4phút+26\%giờ+\) \(10,8phút\)
= 19,2 phút + 14,4 phút + 15,6 phút + 10,8 phút
= 19,2 phút + 10,8 phút + 14,4 phút + 15,6 phút
= (19,2 phút + 10,8 phút)+(14,4 phút + 15,6 phút)
= 20 phút + 30 phút
= 50 phút

Trả lời:
a)9 phút 17 giây +6 phút 42 giây=15 phút 59 giây
b)17 năm 5 tháng - 8 năm 8 tháng=8 năm 9 tháng
c)10 năm 3 tháng x 6=61 năm 6 tháng
d)35 giờ 52 phút :4=8 giờ 58 phút ⚡

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: HCl
+ Quỳ hóa xanh: NaOH
+ Quỳ không đổi màu: NaCl
- Dán nhãn.
hcl đổi màu quỳ tím thành đỏ
Naoh đổi màu quỳ tím thành XAnh
Nacl làm quỳ tím không chuyển màu

a, \(CaCO_3+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Ca+CO_2+H_2O\)
b, Ta có: \(n_{CO_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
Theo PT: \(n_{CH_3COOH}=2n_{CO_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,2.100=20\left(g\right)\)
c, \(n_{\left(CH_3COO\right)_2Ca}=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{\left(CH_3COO\right)_2Ca}=0,1.158=15,8\left(g\right)\)

\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,2 0,2 0,2 0,2
số mol CuO là: \(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{16}{80}=0,2\left(g\right)\)
khối lượng chất tan \(H_2SO_4\text{ là: }\)
\(m_{H_2SO_4}=n_{H_2SO_4}\cdot M_{H_2SO_4}=0,2\cdot98=19,6\left(g\right)\)
nồng độ phần trăm dung dịch \(H_2SO_4\text{ là: }\)
\(C\%=\dfrac{m_{ct}}{m_{dd}}\cdot100\%=\dfrac{19,6}{150}\cdot100\%\approx13,07\%\)

Có 2 đồng phân là : C nối 3 CH nối 2 CH2
CH2 nối 2 C nối 2 CH2
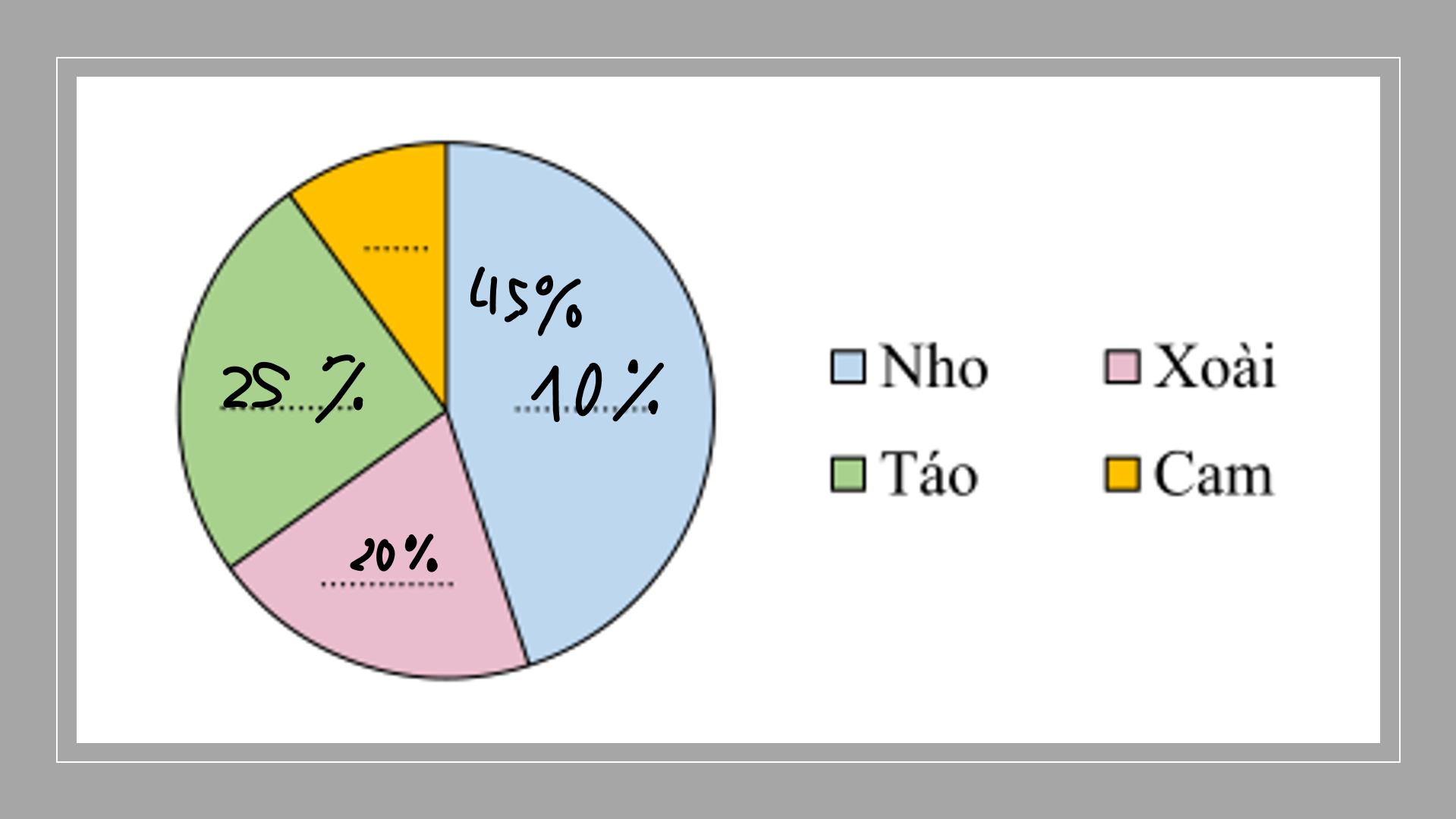
a) Xét △���△ABC có �^+�^+�^=180∘A^+B^+C^=180∘ mà �^=90∘;�^=50∘A^=90∘;B^=50∘ suy ra 90∘+50∘+�^=180∘=>�^=40∘90∘+50∘+C^=180∘=>C^=40∘
b) Xét tam giác △���△BEA và △���△BEH.
có ��BE là cạnh chung
���^=���^(=90∘)��=�� suy ra △���=△��� (c.h-cgv) ⇒���^=���^ suy ⇒BAE=BHE(=90∘)BA=BH ra △ABE=△HBE (c.h-cgv) ABE=HBE.
=>��=>BE là phân giác của �^B
c) �E là giao điểm của hai đường cao trong tam giác ���BKC nên ��BE vuông góc với ��KC.
Tam giác ���BKC cân tại �B có ��BI là đường cao nên ��BI là đường trung tuyến. Do đó �I là trung điểm của ��KC.
a) Xét △���△ABC có �^+�^+�^=180∘A^+B^+C^=180∘ mà �^=90∘;�^=50∘A^=90∘;B^=50∘ suy ra 90∘+50∘+�^=180∘=>�^=40∘90∘+50∘+C^=180∘=>C^=40∘
b) Xét tam giác △���△BEA và △���△BEH.
có ��BE là cạnh chung
���^=���^(=90∘)��=�� suy ra △���=△��� (c.h-cgv) ⇒���^=���^ suy ⇒BAE=BHE(=90∘)BA=BH ra △ABE=△HBE (c.h-cgv) ABE=HBE.
=>��=>BE là phân giác của �^B
c) �E là giao điểm của hai đường cao trong tam giác ���BKC nên ��BE vuông góc với ��KC.
Tam giác ���BKC cân tại �B có ��BI là đường cao nên ��BI là đường trung tuyến. Do đó �I là trung điểm của ��KC.