cho 8,5 g hỗn hợp Na và K tác dụng với nước thu được 3,7185 lít khí hydrogen (đkc) và dung dịch X.Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m g kết tủa. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=0,1.0,1=0,01\left(mol\right)\)
\(Na_2O+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
0,1<-----0,1
\(a=m_{Na_2O}=0,1.62=6,2\left(g\right)\)



a,pt 2Cu + O2 \(\rightarrow\) 2CuO
b, số mol của Cu:1,2:64=0,01875(mol)
khối lượng của CuO: 0,01875* 80=1,5(g)
c, V lít khí của O2: 0,01875* 24,79=0,4648125(lít)


Ta có pt
2Al + 3H2SO4 → Al3(SO4)3+3H2
Pt2 mol 3 mol 1 mol 3 mol
Đb0.2 mol 0.3 mol
Ag không tác dụng vậy mAg là 3 g
Số mol H2 là
nH2=V/22,4 =5,6/22,4= 0,3 ( mol )
Theo pt : nAl = 2/3 nH2 = 2/3 0,3= 0,2 ( mol )
Kl Al là
m Al = M.n = 27 . 0,2 =5,6 ( g )
Kl X là 3+5,6=8,6 (g)
Thành phần phần trăm theo khối lượng của Al là
% Al =m Al/mX .100%= 5,6/8,6.100≈ 65,12 %
Thành phần phần trăm theo khối lượng của Ag là
% Ag= 100% - 65, 12%= 34,88 %

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=0,25.2=0,5\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,2 0,4 0,2 0,2
\(\dfrac{0,2}{1}< \dfrac{0,5}{2}\)=> HCl dư
\(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(C_{M\left(ZnCl_2\right)}=\dfrac{0,2}{0,25}=0,8\left(M\right)\)
\(C_{M\left(HCldu\right)}=\dfrac{0,1}{0,25}=0,4\left(M\right)\)
đktc thì chắc là b học chương trình cũ chứ nhỉ?

a, \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_{2\downarrow}+Na_2SO_4\)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
b, \(m_{CuSO_4}=160.10\%=16\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
Theo PT: \(n_{NaOH}=2n_{CuSO_4}=0,2\left(mol\right)\Rightarrow V_{NaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)
c, \(n_{CuO}=n_{Cu\left(OH\right)_2}=n_{CuSO_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)

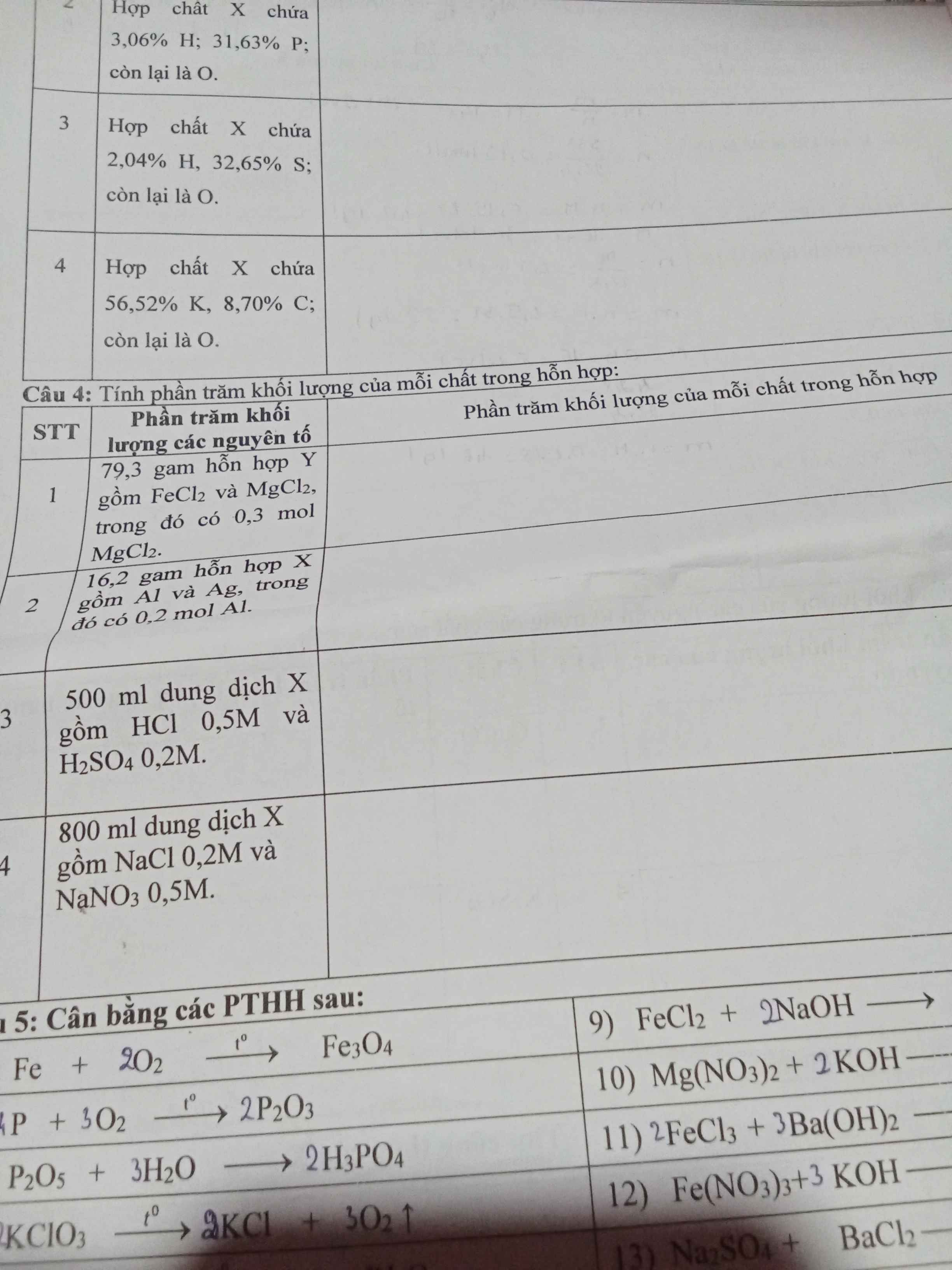
Câu 4:
\(\%m_{MgCl_2}=\dfrac{0,3.95.100\%}{79,3}=35,94\%,\%m_{FeCl_2}=100\%-35,94\%=64,06\%,\)
2) \(\%m_{Al}=\dfrac{0,2.27.100\%}{16,2}=33,33\%\\ \%m_{Ag}=100\%-33,33=66,67\%\)
3) \(n_{HCl}=0,5.0,5=0,25;n_{H_2SO_4}=0,2.0,5=0,1\left(mol\right)\)
\(\%m_{HCl}=\dfrac{0,25.36,5.100\%}{0,25.36,5+0,1.98}=48,22\%\\ \%m_{H_2SO_4}=100\%-48,22\%=51,78\%\)
4)
\(n_{NaCl}=0,2.0,8=0,16\left(mol\right),n_{NaNO_3}=0,5.0,8=0,4\left(mol\right)\Rightarrow\%m_{NaCl}=\dfrac{0,16.58,5.100\%}{0,16.58,5+0,4.85}=21,59\%\Rightarrow\%m_{NaNO_3}=100\%-21,59\%=78,41\%\)

 Ai đó giúp mình với.
Ai đó giúp mình với.


\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
x -------------->x --------->0,5x
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
y------------>y--------->0,5y
\(\left\{{}\begin{matrix}23x+39y=8,5\\0,5x+0,5y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(6NaOH+Fe_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Fe\left(OH\right)_3\)
0,2------------------------------------------->\(\dfrac{1}{15}\)
\(6KOH+Fe_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Fe\left(OH\right)_3\)
0,1------------------------------------------> \(\dfrac{1}{30}\)
\(m_{Fe\left(OH\right)_3}=\left(\dfrac{1}{15}+\dfrac{1}{30}\right).107=10,7\left(g\right)\)