Biết sắt tạo với Clo công thức hoá học là FECl3 .lập công thức hoá học của sắt có hoá trị ở trên với SO4(ll
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CTPT của HC là: NHY3
a. Khối lượng PT của HC là: 63 (đvC)
b. Tính NTK của Y:
14 + 1 + MY x3 = 63
My = 48: 3 = 16
Vậy Y là Oxi có KHHH là: O

+ Hòa tan 3 chất rắn vào nước được 3 dung dịch
+ Nhúng mẩu giấy quỳ tím vào 3 dung dịch
- Dung dịch làm quỳ tím chuyển sang màu đỏ là dung dịch hòa tan từ P2O5
- Dung dịch làm quỳ tím chuyển sang màu xanh là dung dịch hòa tan từ Na2O
- Dung dịch không làm quỳ tím đổi màu là dung dịch hòa tan từ NaCl

500ml=0.5l
nBaOH2 =0.5 x1=0.5 mol
MH2SO4=500.15%=75g
nH2SO4= xấp xỉ 0.8mol
H2SO4 dư tính theo BaOH2
pthh: Ba(OH)2 + H2SO4 => BaSO4+H2O
Theo pthh nBaSO4= nBa(OH)2=0.5mol
=>m kết tủa= 0.5x233=116.5g
theo pthh nH2SO4 phản ứng=nBaOH2= 0.5 mol
=> nH2SO4 Dư=0.8-0.5=0.3 mol
=>
m dư=0.3x98=29.4g
mH2SO4 đã dùng là m phản ứng? nếu thế thì m đã dung là 75-29.4=45.6
còn nếu m đã dùng là m chất tan thi là 75g như trên =))

I. \(\left\{{}\begin{matrix}n_{HCl}=0,5.0,2=0,1\left(mol\right)\\n_{NaOH}=0,3.0,5=0,15\left(mol\right)\end{matrix}\right.\)
PTHH: NaOH + HCl ---> NaCl + H2O
bđ 0,15 0,1
sau pư 0,05 0
`=>` \(C_{M\left(NaOH\right)}=\dfrac{0,05}{0,2+0,3}=0,1M\)
`=>` \(\left[OH^-\right]=0,1M=10^{-1}M\)
`=>` \(pOH=1\Rightarrow pH=14-1=13\)
II.
| CTHH của chất | PT điện ly |
| HNO3 | \(HNO_3\rightarrow H^++NO_3^-\) |
| Ba(OH)2 | \(Ba\left(OH\right)_2\rightarrow Ba^{2+}+2OH^-\) |
| NaOH | \(NaOH\rightarrow Na^++OH^-\) |
| H2SO4 | \(H_2SO_4\rightarrow2H^++SO_4^{2-}\) |
| Ca(OH)2 | \(Ca\left(OH\right)_2\rightarrow Ca^{2+}+2OH^-\) |
| Na2CO3 | \(Na_2CO_3\rightarrow2Na^++CO_3^{2-}\) |
| BaCl2 | \(BaCl_2\rightarrow Ba^{2+}+2Cl^-\) |
| NaHCO3 | \(NaHCO_3\rightarrow Na^++HCO_3^-\\ HCO_3^-⇌H^++CO_3^{2-}\) |
| H2S | \(H_2S⇌H^++HS^-\\ HS^-\rightarrow H^++S^{2-}\) |
2.
| CTHH của chất | PT điện ly |
| CuSO4 | \(CuSO_4\rightarrow Cu^{2+}+SO_4^{2-}\) |
| Na2SO4 | \(Na_2SO_4\rightarrow2Na^++SO_4^{2-}\) |
| Fe2(SO4)3 | \(Fe_2\left(SO_4\right)_3\rightarrow2Fe^{3+}+3SO_4^{2-}\) |
| \(Na_2HPO_4\) | \(Na_2HPO_4\rightarrow2Na^++HPO_4^{2-}\\ HPO_4^{2-}⇌H^++PO_4^{3-}\) |
| Mg(OH)2 | \(Mg\left(OH\right)_2⇌Mg^{2+}+2OH^-\) |
| CH3COOH | \(CH_3COOH⇌CH_3COO^-+H^+\) |
| H3PO4 | \(H_3PO_4⇌H^++H_2PO_4^-\\ H_2PO_4⇌H^++HPO_4^{2-}\\ HPO_4^{2-}⇌H^++PO_4^{3-}\) |
| HF | \(HF⇌H^++F^-\) |

`Mg + H_2SO_4 -> MgSO_4 + H_2`
`Fe + H_2SO_4 -> FeSO_4 + H_2`
`2Al + 3H_2SO_4 -> Al_2(SO_4)_3 + 3H_2`
`H_2SO_4 + 2KOH -> K_2SO_4 + 2H_2O`
`MgSO_4 + 2KOH -> Mg(OH)_2 + K_2SO_4`
`FeSO_4 + 2KOH -> Fe(OH)_2 + K_2SO_4`
`Al_2(SO_4)_3 + 6KOH -> 2Al(OH)_3 + 3K_2SO_4`
`Al(OH)_3 + KOH -> KAlO_2 + 2H_2O`
$Mg(OH)_2 \xrightarrow{t^o} MgO + H_2O$
$4Fe(OH)_2 + O_2 \xrightarrrow{t^o} 2Fe_2O_3 + 4H_2O$
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
Ta có: \(M_X=32.2=64\left(g/mol\right)\Rightarrow X:SO_2\)
`Mg(OH)_2 + H_2SO_4 -> MgSO_4 + 2H_2O`
`2Fe(OH)_2 + 4H_2SO_{4(đ,n)} -> Fe_2(SO_4)_3 + SO_2 + 6H_2O`
`Cu + 2H_2SO_{4(đ,n)} -> CuSO_4 + SO_2 + 2H_2O`
`CO_2 + KOH -> KHCO_3`
`CO_2 + KAlO_2 + 2H_2O -> Al(OH)_3 + KHCO_3`

Là sinh học,hóa học, vật lí học ,khoa học trái đất , thiên văn học
Khoa học tự nhiên bao gồm một số lĩnh vực chính như: Vật lí học nghiên cứu về vật chất, quy luật vận động, lực, năng lượng và sự biến đổi năng lượng. Hoá học nghiên cứu về chất và sự biến đổi của chúng. Sinh học hay sinh vật học nghiên cứu về các vật sống, mối quan hệ giữa chúng với nhau và với môi trường
#Tham khảo

Theo bài ra, ta có: \(p+e+n=34\Leftrightarrow2p+n=34\)
Ta có: \(p\le n\le1,5p\)
`=>` \(3p\le2p+n\le3,5p\)
`=>` \(3p\le34\le3,5p\)
`=>` \(9,71\le n\le11,33\)
`=> p in {10; 11}`
Với \(p=10\Rightarrow\left\{{}\begin{matrix}e=p=10\\n=34-10.2=14\end{matrix}\right.\left(\text{Loại}\right)\)
Với \(p=11\Rightarrow\left\{{}\begin{matrix}e=p=11\\n=34-11.2=12\end{matrix}\right.\left(\text{Chọn}\right)\)
`=> X: Natri (Na)`
`=>` \(m_{Na}=11.\left(1,6726.10^{-27}+9,11.10^{-31}\right)+12.1,6747.10^{-27}=3,850521.10^{-26}\left(kg\right)\)
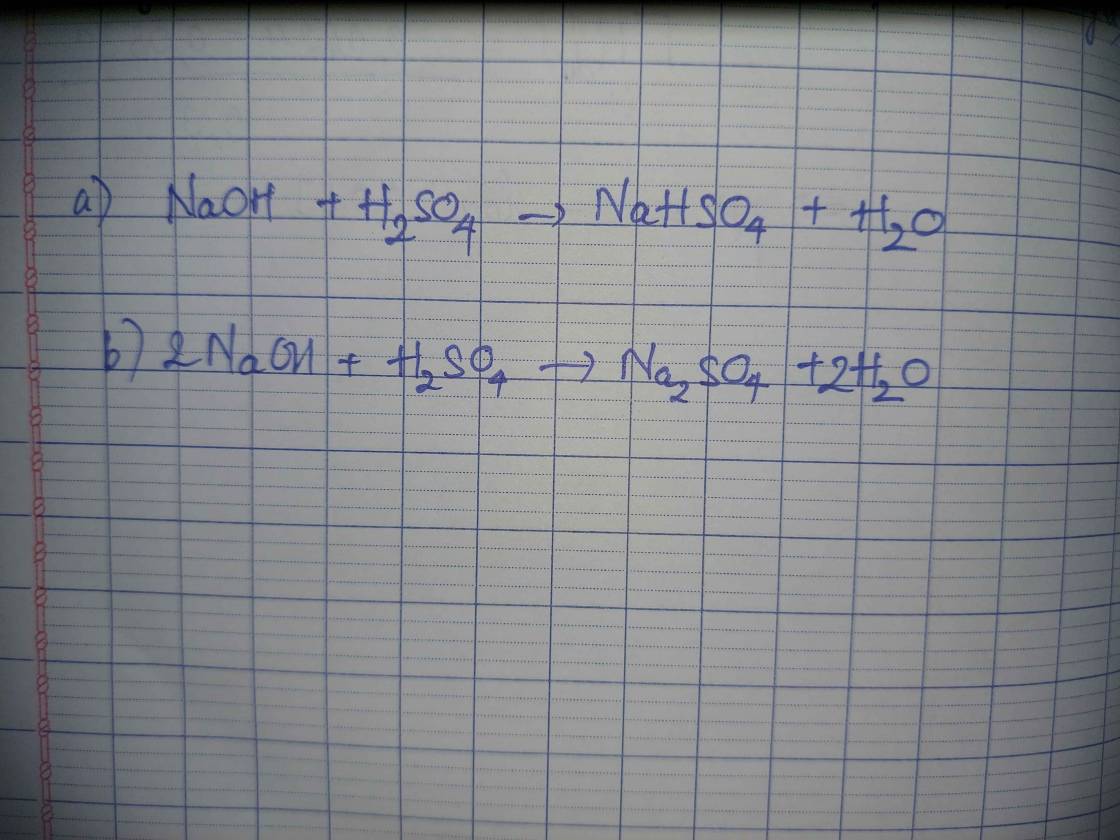
Hóa trị của Fe là: III x 3: 1 = III
Công thức cần lập: Fe2(SO4)3
Fe có hóa trị là : 3 (số la mã)
Fe2(SO4)3