3C2H5OH + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
có bao nhiêu H2SO4 là môi trường trong phản ứng trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cứ mỗi nguyên tử H trong axit liên kết với một nhóm -MnO4 trong thuốc tím để tạo ra 1 phân tử axit HMnO4 có tính oxi hóa
Trong PTHH có 6 phân tử KMnO4 -> có 6 nhóm -MnO4 -> có 6 nguyên tử H đóng vai trò là môi trường -> có 3 phân tử H2SO4 đóng vai trò là môi trường

- Đối với các phản ứng hóa học có chất rắn tham gia thì khi tăng diện tích bề mặt, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ phản ứng, nhưng không tiêu hao trong quá trình phản ứng.
~ HT ~
Tốc độ phản ứng chỉ có chất rắn tham gia và tạo thành sau phản ứng không phụ thuộc vào: áp suất.

Ta có: \(\left\{{}\begin{matrix}p+e+n=58+2=60\\p=e\\p+e-n=20\end{matrix}\right.\Leftrightarrow p=e=n=\dfrac{60}{3}=20\)
=> X là Canxi
Cấu hình electron: \(1s^22s^22p^63s^23p^64s^2\)
=> Có 4 lớp e nên ở chu kì 4, lớp e cuối cùng có 2e nên ở nhóm IIA, vị trí số 20
a có: \left\{{}\begin{matrix}p+e+n=58+2=60\\p=e\\p+e-n=20\end{matrix}\right.\Leftrightarrow p=e=n=\dfrac{60}{3}=20⎩⎨⎧p+e+n=58+2=60p=ep+e−n=20⇔p=e=n=360=20
=> X là Canxi
Cấu hình electron: 1s^22s^22p^63s^23p^64s^21s22s22p63s23p64s2
=> Có 4 lớp e nên ở chu kì 4, lớp e cuối cùng có 2e nên ở nhóm IIA, vị trí số 20
Đúng(2)
\(2X+2H_2O\rightarrow2XOH+H_2\\ n_{H_2}=\dfrac{0,3}{2}=0,15\left(mol\right)\\ n_X=2.0,15=0,3\left(mol\right)\\ M_X=\dfrac{8,5}{0,3}\approx28,333\\ \Rightarrow M_{Na}< M_X< M_K\left(23< 28,333< 39\right)\\ Đặt:n_{Na}=a\left(mol\right);n_K=b\left(mol\right)\\ \Rightarrow\left\{{}\begin{matrix}23a+39b=8,5\\0,5a+0,5b=0,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ \Rightarrow\%m_{Na}=\dfrac{23a}{8,5}.100\%0=\dfrac{23.0,2}{8,5}.100\%\approx54,12\%\\ \Rightarrow Chọn.A\)

Gọi hóa trị của M là n
\(n_{H_2}=\dfrac{0,2479}{24,79}=0,01\left(mol\right);n_{M\left(OH\right)_n}=0,5.0,04=0,02\left(mol\right)\)
PTHH: \(2M+2nH_2O\rightarrow2M\left(OH\right)_n+nH_2\)
\(\dfrac{0,02}{n}\)<--------------\(\dfrac{0,02}{n}\)<--------0,01
\(M_2O_n+nH_2O\rightarrow2M\left(OH\right)_n\)
Theo PTHH: \(n_{M\left(OH\right)_n}=2n_{M_2O_n}+n_M\)
=> \(n_{M_2O_n}=\dfrac{0,02-\dfrac{0,02}{n}}{2}=0,01-\dfrac{0,01}{n}\left(mol\right)\)
=> \(\dfrac{0,01}{n}< 0,01\Leftrightarrow n>1\)
Do M là kim loại tan trong nước nên n = 2
=> \(n_M=\dfrac{0,02}{2}=0,01\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT M}}n_{MO}=n_{M\left(OH\right)_2}-n_M=0,02-0,01=0,01\left(mol\right)\)
=> \(0,01.\left(M_M+16\right)+0,01.M_M=2,9\)
=> \(M_M=137\left(g/mol\right)\)
=> M là Barium (Ba)
M : x mol ; M2On : y mol
⇒ n M(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,005
⇒ mhh = 0,01.M + 0,005.(2M + 16.2) = 2,9
⇒ M = Ba

a. Công thức Lewis của CO2: 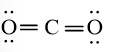
Công thức cấu tạo của CO2 là: O = C = O.
Công thức Lewis của NH3 là: 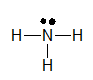
Công thức cấu tạo của NH3 là: \(H-N-H\)
\(|\)
H
b. Hợp chất tan trong nước: CO2 và NH3
Trong CO2CO2 chứa hai liên kết cộng hóa trị phân cực C=OC=O (đều phân cực về phía OO). Tuy nhiên, CO2CO2 có cấu trúc phân tử thẳng (O=C=OO=C=O) → 2 vectơ mô men cực cùng phương, ngược hướng triệt tiêu nhau → Phân tử CO2CO2 không phân cực nên có tan trong nước song là ít tan
+ NH3 tan tốt trong nước vì NH3 có liên kết cộng hóa trị phân cực trong phân tử

a, Y có số hiệu nguyên tử là 8 => Y là oxi
=> cấu hình electron là: \(1s^22s^22p^4\)
X có số hiệu nguyên tử là 11 => X là natri
=> cấu hình electron là: \(1s^22s^22p^63s^1\)
b.O + 2e → O2-
2Na \(\rightarrow\) 2Na\(^{1+}\)+2e
=> \(2Na^{1+}+O^{-2}\rightarrow Na_2O\)