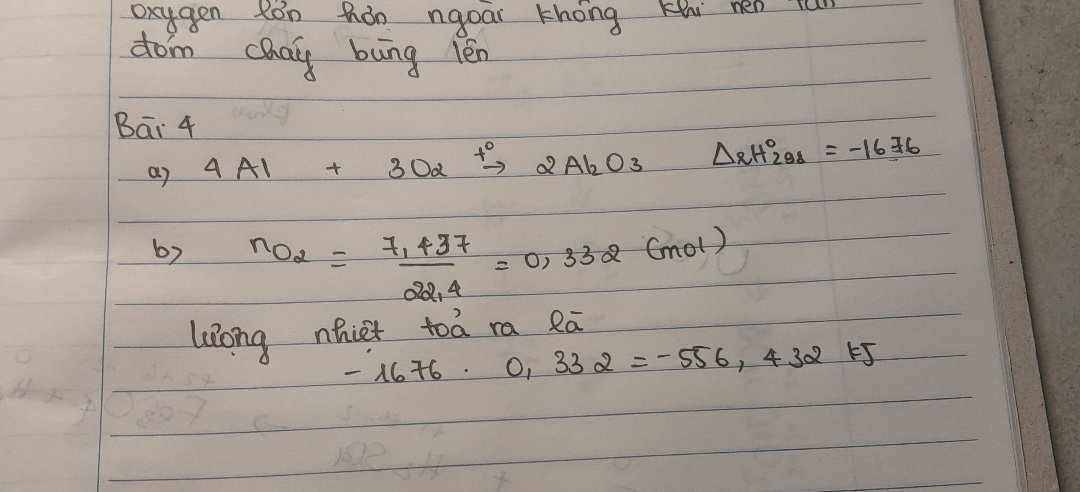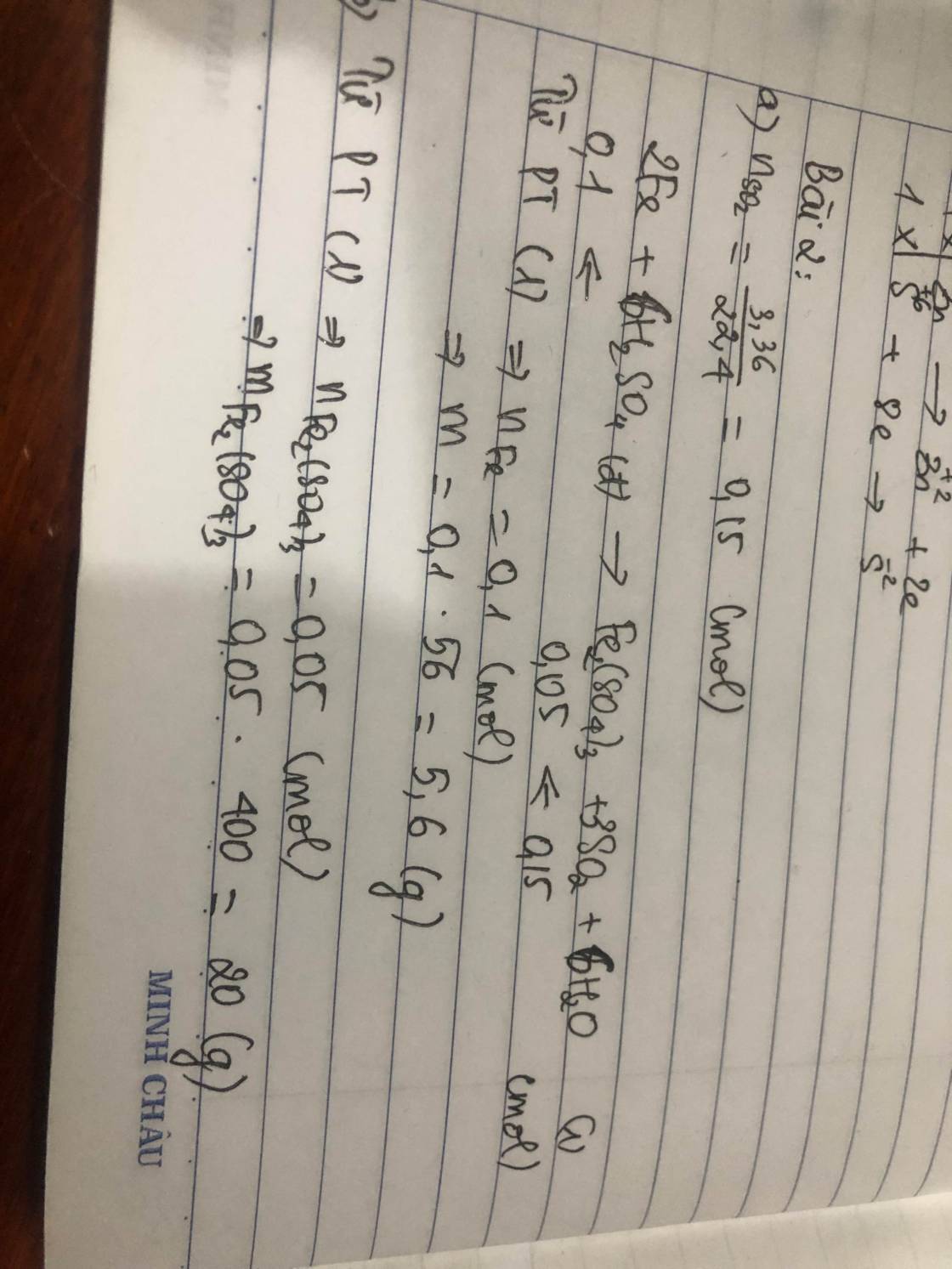A, B, C là các hợp chất của Na ; A tác dụng được với B tạo thành C . Khi cho C tác dụng với dung dịch HCl thấy bay ra khí cacbonic . Hỏi A , B , C là những chất gì ? Cho A, B, C lần lượt tác dụng với dung dịch đặc CaCl2 . Viết các phương trình phản ứng xảy ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Gọi x,y lần lượt là số mol của Zn và Al
Theo đề ta có mHỗnhợp=65x+27y=9,2(1)
nSO2=5,6:22,4=0,25mol
BTE:2x+3y=2.0,25=0,5(2)
Từ (1) và (2) => x=0,1;y=0,1
mAl=0,1.27=2,7g
Chúc bạn học tốt!!!

Vì tỷ lệ nguyên tử khối là 3:5:7.
⇒ Gọi nguyên tử khối của chúng lần lượt là: 3M, 5M và 7M.
Tỷ lệ số mol là 4:2:1
⇒ Gọi số mol của chúng lần lượt là: 4a, 2a và a (mol)
⇒ 3M.4a + 5M.2a + 7M.a = 11,6 ⇒ M.a = 0,4 (1)
Ta có: \(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Gọi hh 3 KL chung là X.
⇒ nX = 4a + 2a + a = 7a (mol)
PT: \(X+2HCl\rightarrow XCl_2+H_2\)
Theo PT: \(n_X=n_{H_2}=0,35\left(mol\right)\)
⇒ 7a = 0,35 (2)
Từ (1) và (2) ⇒ a = 0,05 (mol), M = 8
⇒ Nguyên tử khối của các KL lần lượt là: 24, 40 và 56
Vậy: Các KL lần lượt là: Mg, Ca và Fe.

Ta có:
Ca(NO3)2 có %N=14x2/(40+14x2+16x6)≈17,07%
NH4NO3 có %N=14x2/(14+4+14+16x3)=35%
Nếu dùng Ca(NO3)2
mCa(NO3)2=56/17,07%=328 kg -> m A=328/82%=400kg
Nếu dùng NH4NO3
-> mNH4NO3=56/35%=160 kg -> mB=160/80%=200kg
-> mua phana B sẽ ít hơn đỡ tốn công vận chuyển hơn (400>200)

a) Oxygen duy trì sự hô hấp, khi ở nơi đông người trong không gian kín nồng độ oxygen càng loãng.
⇒ Nồng độ oxygen trong không khí không đủ để cung cấp cho mọi người.
⇒ Ta cảm thấp khó thở và phải thở nhanh hơn để lấy được nhiều oxygen hơn.
b) Vì oxygen duy trì sự cháy mà trong bình khí oxygen nguyên chất, nồng độ oxygen lớn hơn ngoài không khí nên tàn đóm cháy bùng lên.

\(a.2Fe+6H_2SO_{4\left(đặc\right)}\rightarrow\left(t^o\right)Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\\ n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{Fe}=\dfrac{2}{3}.0,15=0,1\left(mol\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,15}{3}=0,05\left(mol\right)\\ a,m=m_{Fe}=0,1.56=5,6\left(g\right)\\ b,m_{Fe_2\left(SO_4\right)_3}=400.0,05=20\left(g\right)\)