Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử: 1 gam C và Al
+ 1 gam C có 1/12 mol
1 mol C : ${\Delta _r},H_{298}^0$ = -393,5 kJ
1/12 mol C ${\Delta _r},H_{298}^0$ = -32,79 kJ
+ 1 gam Al có 1/27 mol
2 mol Al : ${\Delta _r},H_{298}^0$= -1675,7 kJ
1/27mol Al : ${\Delta _r},H_{298}^0$= -31,03 kJ
⇒ Với cùng một khối lượng C và Al, C khi đốt cháy tỏa ra nhiều nhiệt hơn.

∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ

\(\Delta_rH^{^{ }o}_{298}=3\cdot436+945-2\left(3\cdot386\right)=-63kJ\cdot mol^{-1}\)
Sơ đồ:


\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)

\(N_2O_4+3CO->N_2O+3CO_2\\ \Delta_rH^o_{298}=82,05+3\left(-393,50\right)-\left(9,16+3\left(-110,50\right)\right)\\ \Delta_rH^o_{298}=-776,11kJ\)

Nhiệt tỏa ra khi hình thành 1 mol Na2O(s) ở điều kiện chuẩn từ phản ứng giữa Na(s) và O3(g) không được coi là nhiệt tạo thành chuẩn của Na2O(s) vì oxygen dạng phân tử O3 (ozone) không là dạng bền nhất.

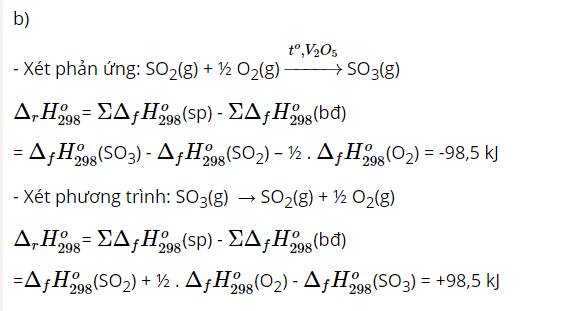

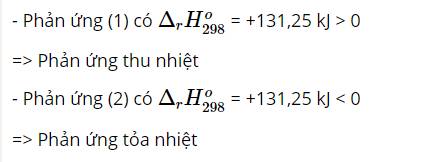
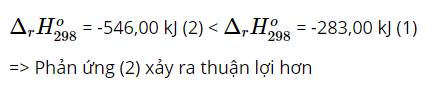
Dưới đây là lời giải chi tiết cho từng bài:
Bài 1:
Phản ứng:
\(2 A l \left(\right. s \left.\right) + \frac{3}{2} O_{2} \left(\right. g \left.\right) \rightarrow A l_{2} O_{3} \left(\right. s \left.\right) \Delta H = - 1675,7 \&\text{nbsp};\text{kJ}\)
Khối lượng \(A l_{2} O_{3}\) cho: 10,2 gam
Bước 1: Tính số mol Al₂O₃:
Bước 2: Dựa vào phản ứng, ta thấy:
→ 0,1 mol sẽ tỏa ra:
\(Q = 0,1 \times 1675,7 = \boxed{167,57 \&\text{nbsp};\text{kJ}}\)
Bài 2:
Phản ứng:
\(S O_{2} \left(\right. g \left.\right) + \frac{1}{2} O_{2} \left(\right. g \left.\right) \rightarrow S O_{3} \left(\right. g \left.\right) \Delta H = - 98,5 \&\text{nbsp};\text{kJ}\)
Cho: \(m_{S O_{2}} = 74,6 \&\text{nbsp};\text{gam}\)
Bước 1: Tính số mol SO₂:
\(M \left(\right. S O_{2} \left.\right) = 32 + 2 \times 16 = 64 \&\text{nbsp};\text{g}/\text{mol}\) \(n = \frac{74,6}{64} = 1,165625 \approx 1,166 \&\text{nbsp};\text{mol}\)
Bước 2: Tính nhiệt lượng tỏa ra:
\(Q = 1,166 \times 98,5 \approx \boxed{114,88 \&\text{nbsp};\text{kJ}}\)
Bài 3:
Phản ứng:
\(2 S O_{2} \left(\right. g \left.\right) + O_{2} \left(\right. g \left.\right) \rightarrow 2 S O_{3} \left(\right. g \left.\right) \Delta H = - 197,0 \&\text{nbsp};\text{kJ} \left(\right. \text{g} \overset{ˊ}{\hat{\text{a}}} \text{p}\&\text{nbsp};đ \hat{\text{o}} \text{i}\&\text{nbsp};\text{ph}ả\text{n}\&\text{nbsp};ứ\text{ng}\&\text{nbsp};\text{b} \overset{ˋ}{\text{a}} \text{i}\&\text{nbsp};\text{2} \left.\right)\)
Cho: \(m_{S O_{2}} = 7,68 \&\text{nbsp};\text{gam}\)
Bước 1: Tính số mol SO₂:
\(n = \frac{7,68}{64} = 0,12 \&\text{nbsp};\text{mol}\)
Bước 2: Phản ứng sinh ra bao nhiêu nhiệt?
⇒ 1 mol \(S O_{2}\) → tỏa ra \(\frac{197,0}{2} = 98,5 \&\text{nbsp};\text{kJ}\)
⇒ 0,12 mol \(S O_{2}\) → tỏa ra:
\(Q = 0,12 \times 98,5 = \boxed{11,82 \&\text{nbsp};\text{kJ}}\)
✅ Tóm tắt đáp án: