Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Đặt CTTQ \(Na_a^ICl_b^I\left(a,b:nguyên,dương\right)\)
Theo NT hoá trị, ta có:
\(a.I=b.I\Rightarrow\dfrac{a}{b}=\dfrac{I}{I}=\dfrac{1}{1}\\ \Rightarrow a=1;b=1\\ \Rightarrow CTHH:NaCl\)
\(b,\%m_{Na}=\dfrac{23}{23+35,5}.100\%\approx39,316\%\\ \%m_{Cl}\approx100\%-39,316\%\approx60,684\%\)

- O= Oxygen
Tác dụng: Là một khí quan trọng giúp ta hô hấp cũng như giúp các sinh vật trên trái đất hô hấp
- Na= Sodium(Natri)
Công dụng: giúp cân bằng nồng độ chất lỏng, điều tiết hoạt động của thận, giữ cho huyết áp ổn định, cần thiết cho sự phát triển não bộ
- C = Carbon Carbon là thành phần thiết yếu của sự sống trên Trái Đất. Nó có vai trò quan trọng trong kết cấu, hóa sinh học và dinh dưỡng của mọi tế bào.
- BA = Bari dưới dạng kim loại hoặc hợp kim với nhôm, được sử dụng để làm chất thu khí loại bỏ khí không mong muốn trong các ống chân không, chẳng hạn như đèn hình màu tivi.
Ứng dụng này hiện đang dần biến mất với sự ra đời của các loại tivi màn hình LCD và màn hình plasma không có ống chân không.
Trên đây là mình tổng hợp ý nghĩa trên wikipedia tiếng việt![]()
---Hết---

`#3107.101107`
a. Sửa đề: Hãy cho biết khối lượng nguyên tử của mỗi nguyên tố có trong phân tử đó.
- Trong phân tử \(\text{SO}_2\) gồm 2 nguyên tử, nguyên tử S và O
`=>` NTK của S là `32` amu, NTK của phân tử O là `16` amu
b.
Khối lượng phân tử của SO2 là:
\(32+16\cdot2=64\left(\text{amu}\right)\)
c.
Số `%` của S có trong SO2 là:
\(\text{%S }=\dfrac{32\cdot100}{64}=50\left(\%\right)\)
Số `%` của O2 có trong SO2 là:
\(\text{%O = 100%}-\text{50% = 50%}\)
Vậy:
a. S: `32` amu, O: `16` amu
b. PTK của SO2 là `64` amu
c. \(\text{%S = 50%; %O = 50%.}\)

1. Lập công thức khi biết hóa trị
Giả sử hợp chất gồm 2 nguyên tố A và B, có hóa trị lần lượt là \(x\) và \(y\).
- Quy tắc: Tích chéo hóa trị → chỉ số nguyên tử.
\(A_{x} B_{y} \rightarrow A_{y} B_{x}\)
📌 Ví dụ: Lập công thức của hợp chất giữa Al (III) và O (II):
\(A l^{3 +} , \&\text{nbsp}; O^{2 -} \Rightarrow A l_{2} O_{3}\)
2. Lập công thức khi biết thành phần phần trăm khối lượng các nguyên tố
Quy trình:
Bước 1: Giả sử có 100 g hợp chất
→ số gam mỗi nguyên tố chính bằng phần trăm của nó.
Bước 2: Tính số mol từng nguyên tố
\(n = \frac{\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}\&\text{nbsp};\text{l}ượ\text{ng}}{\text{nguy} \hat{\text{e}} \text{n}\&\text{nbsp};\text{t}ử\&\text{nbsp};\text{kh} \overset{ˊ}{\hat{\text{o}}} \text{i}}\)
Bước 3: Chia số mol cho giá trị nhỏ nhất
→ được tỉ lệ số nguyên tử gần đúng.
Bước 4: Rút gọn thành số nguyên tối giản
→ đó là công thức đơn giản nhất (công thức nguyên).
Bước 5 (nếu đề cho M – khối lượng mol của hợp chất):
Tính hệ số \(k = \frac{M_{t h ự c}}{M_{đo n g i ả n}}\).
Nhân toàn bộ chỉ số trong công thức đơn giản với \(k\) để ra công thức phân tử.
📌 Ví dụ: Hợp chất X có 40% C, 6,7% H, 53,3% O. Xác định công thức.
- Giả sử 100 g chất → C: 40 g, H: 6,7 g, O: 53,3 g.
- Số mol:
\(n_{C} = \frac{40}{12} \approx 3.33 , n_{H} = \frac{6.7}{1} \approx 6.7 , n_{O} = \frac{53.3}{16} \approx 3.33\) - Chia cho số nhỏ nhất (3.33):
\(C : 1 , \&\text{nbsp}; H : 2 , \&\text{nbsp}; O : 1\)
→ Công thức đơn giản nhất: CH₂O.
- Nếu khối lượng mol thực tế cho là 60 g/mol → khối lượng mol CH₂O = 30 → \(k = 2\).
→ Công thức phân tử: C₂H₄O₂.

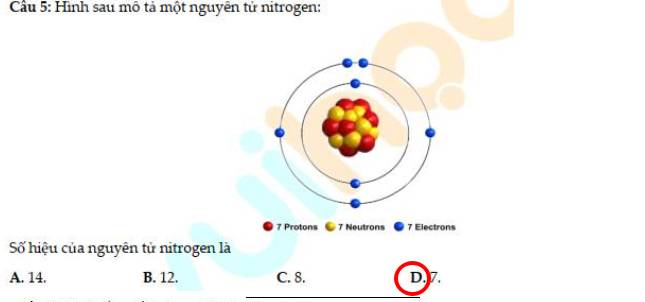
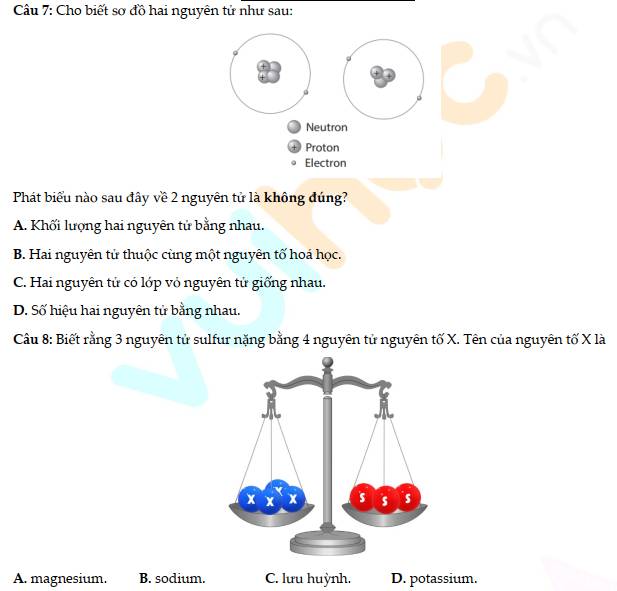
4 - D

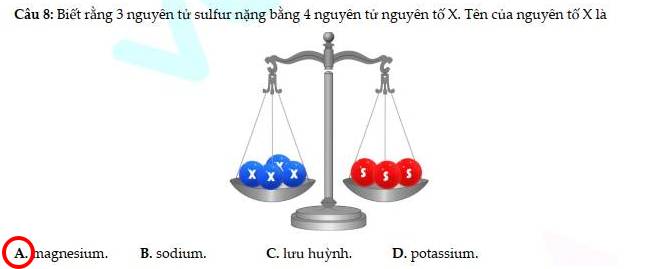
Vì 1 nguyên tử S có khối lượng là 32 amu
`=>` 3 nguyên tử S có khối lượng là: `32 * 3 = 96 (am``u)`
Vì 4 nguyên tử x và 3 nguyên tử S bằng nhau
`=> 4*x = 96`
`=> x = 24`
Vậy, khối lượng `1` nguyên tử x là `24` amu`
`=>` X là Magnesium

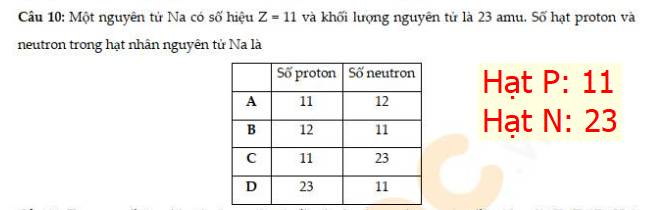
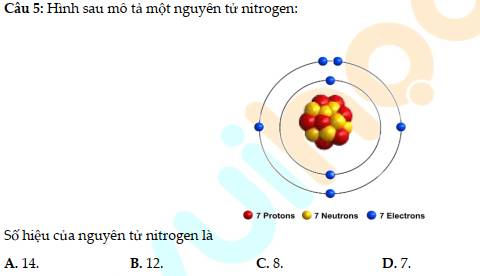
14 - B
- Nước có CTHH là \(\text{H}_2\text{O}\), được tạo bởi 2 nguyên tử nguyên tố Hydrogen và Oxygen.
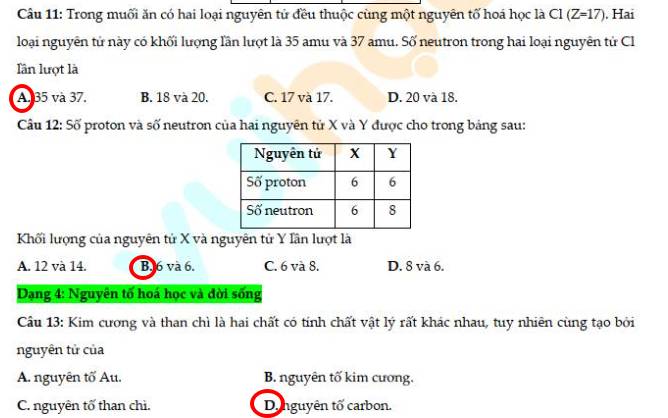
15 - D
- Na là kí hiệu HH của nguyên tử nguyên tố Sodium (Natri)
- K là kí hiệu HH của nguyên tử nguyên tố Potassium (Kali).

Có 20 quả cam và 12 quả táo trong tủ lạnh. Hương ko nhìn vào tủ và lấy ra 1 quả bất kì. Hỏi Hương có thể lấy ra qả gì từ trong tủ?
Dựa trên hoá trị của các nguyên tố, ta có thể lập các công thức hóa học giữa các nguyên tố O (hoá trị II), Na (hoá trị I), và C (hoá trị VI). Dưới đây là các công thức có thể có giữa chúng: 1. Na và O (Na₂O): Na có hoá trị I, O có hoá trị II. Để đảm bảo sự cân bằng về điện tích, ta cần 2 ion Na⁺ cho mỗi ion O²⁻. Công thức: Na₂O (Natri oxit). 2. Na và C (Na₂C): Na có hoá trị I, C có hoá trị VI. Để cân bằng điện tích, ta cần 2 ion Na⁺ cho mỗi ion C⁶⁻. Công thức: Na₂C (Natri cacbua). 3. O và C (CO₂): C có hoá trị VI và O có hoá trị II. Cần 2 ion O²⁻ cho mỗi ion C⁶⁻. Công thức: CO₂ (Cacbon điôxít). 4. Na, O và C (Na₂CO₃): Na có hoá trị I, O có hoá trị II, và C có hoá trị VI. Để cân bằng điện tích, ta cần 2 ion Na⁺ cho mỗi ion CO₃²⁻. Công thức: Na₂CO₃ (Natri cacbua). Tóm lại, các công thức có thể có giữa O (II), Na (I), và C (VI) là: Na₂O (Natri oxit) Na₂C (Natri cacbua) CO₂ (Cacbon điôxít) Na₂CO₃ (Natri cacbonat)
Con mời thượng đế tham khảo !