Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn ơi Đồng I hay II
Ta có nNaOH = \(\dfrac{20}{40}\) = 0,5 ( mol )
nCuCl2 = \(\dfrac{27}{135}\) = 0,2 ( mol )
2NaOH + CuCl2 \(\rightarrow\) Cu(OH)2 + 2NaCl
0,5..............0,2
=> Lập tỉ số : \(\dfrac{0,5}{2}:\dfrac{0,2}{2}\) = 0,25 > 0,2
=> Sau phản ứng NaOH dư ; CuCl2 hết
=> mNaOH dư = ( 0,5 - 0,4 ) . 40 = 4 ( gam )

a. PTHH: 2Al(OH)3 + 3H2SO4 ---> Al2(SO4)3 + 6H2O
b. Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,75}{2}>\dfrac{0,5}{3}\)
Vậy \(Al\left(OH\right)_3\) dư.
\(m_{dư}=0,75.78-98.0,5=9,5\left(g\right)\)
c. Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}.n_{H_2SO_4}=\dfrac{1}{3}.0,5=\dfrac{1}{6}\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)

a, \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right);n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
PTHH: 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Mol: \(\dfrac{1}{3}\) 0,5 \(\dfrac{1}{6}\)
b, Ta có: \(\dfrac{0,75}{2}>\dfrac{0,5}{3}\) ⇒ Al(OH)3 dư, H2SO4 hết
⇒ \(m_{Al\left(OH\right)_3}=\left(0,75-\dfrac{1}{3}\right).78=32,5\left(g\right)\)
c, \(m_{Al_2\left(SO_4\right)_3}=\dfrac{1}{6}.342=57\left(g\right)\)
Ta có: \(n_{Al\left(OH\right)_3}=\dfrac{58,5}{78}=0,75\left(mol\right)\)
a. PTHH: 2Al(OH)3 + 3H2SO4 ---> Al2(SO4)3 + 6H2O
b. Không có chất dư (hoặc có thể bn cho sai 49(g) dung dịch là 49(g) H2SO4)
c. Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}.n_{Al\left(OH\right)_3}=\dfrac{1}{2}.0,75=0,375\left(mol\right)\)
=> \(m_{Al_2\left(SO_4\right)_3}=0,375.342=128,25\left(g\right)\)

a/ PTHH: 2Fe(OH)3 ==(nhiệt)==> Fe2O3 + 3H2O
ÁP dụng định luật bảo toàn khối luọng, ta có:
mFe(OH)3(pứ) = mFe2O3 + nH2O = 80 + 27 = 107 gam
=> %mFe(OH)3(bị phân hủy) = \(\frac{107}{200}.100\%=53,5\%\)
b/ Sau phản ứng có 3 chất đó là: Fe2O3, H2O và Fe(OH)3 dư
- mFe2O3 = 80 gam
- mH2O = 27 gam
- mFe(OH)3 dư = 200 - 107 = 93 gam

a) PTHH: 2 Na + 2 H2O -> 2 NaOH + H2
b) Theo Định luật bảo toàn khối lượng, ta có:
mNa+mH2O=mNaOH +mH2
<=> mNa+ 36=80+3
<=>mNa= 47(g)
(Thật ram em xem lại nha, tính toán thì ra 47 gam, nhưng thực tế mà nói thì anh nghĩ ra 46 gam và 2 gam nước, coi lại chỗ KL nước he)

nZn = 19.5/65 = 0.3 (mol)
Zn + H2SO4 => ZnSO4 + H2
0.3........................0.3.........0.3
VH2 = 0.3*22.4 = 6.72 (l)
mZnSO4 = 0.3*161 = 48.3 (g)
nCuO = 16/80 = 0.2 (mol)
CuO + H2 -to-> Cu + H2O
0.2........0.2
=> H2 dư
mH2 (dư) = ( 0.3 - 0.2 ) * 2 = 0.2 (g)
nZn=0,3(mol)
a) PTHH: Zn + H2SO4 -> ZnSO4+ H2
0,3___________________0,3____0,3(mol)
mZnSO4=161.0,3=48,3(g)
b) V(H2,đktc)=0,3.22,4=6,72(l)
c) nCuO=16/80=0,2(mol)
PTHH: CuO + H2 -to-> Cu + H2O
vì: 0,3/1 > 0,2/1
=> H2 dư, CuO hết, tính theo nCuO
=> n(H2,dư)=0,3-0,2=0,1(mol)
=> mH2(dư)=0,1.2=0,2(g)



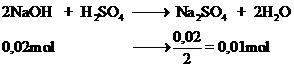


Bạn ơi Đồng I hay II Clorua mới được chứ
Mình chọn Đồng II Clorua nha vì thường là II chứ rất ít là I
Ta có nNaOH = \(\dfrac{20}{40}\) = 0,5 ( mol )
=> nCuCl2 = \(\dfrac{27}{135}\) = 0,2 ( mol )
2NaOH + CuCl2 \(\rightarrow\) Cu(OH)2 + 2NaCl
0,5.............0,2
=> Lập tỉ số \(\dfrac{0,5}{2}:\dfrac{0,2}{1}\) = 0,25 > 0,2
=> Sau phản ứng NaOH còn dư ; CuCl2 hết
=> mNaOH = ( 0,5 - 0,4 ) . 40 = 4 ( gam )
ở cấp 2 thì chỉ xét đến đồng 2 thôi Elly Phạm