Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Mô hình động học phân tử chất khí SVIP
Tải đề xuống bằng file Word
I. CHUYỂN ĐỘNG VÀ TƯƠNG TÁC CỦA CÁC PHÂN TỬ KHÍ
1. Chuyển động Brown trong chất khí
Chuyển động Brown không chỉ xảy ra trong chất lỏng mà xảy ra cả trong chất khí.
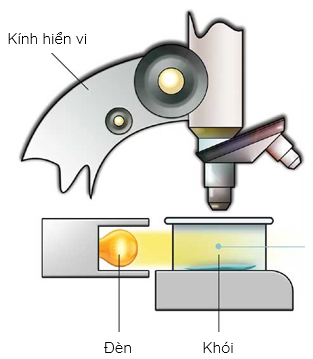
Sơ đồ thí nghiệm quan sát chuyển động Brown trong không khí

Quỹ đạo chuyển động của hạt khói trong không khí
Từ thí nghiệm trên có thể rút ra các kết luận sau:
- Chất khí được cấu tạo từ các phân tử chuyển động hỗn loạn, không ngừng.
- Nhiệt độ của khí càng cao thì tốc độ chuyển động hỗn loạn của các phân tử khí càng lớn.
❗Trong khi chuyển động hỗn loạn, các phân tử khí không ngừng va chạm với nhau và với thành bình nên tốc độ chuyển động của chúng không ngừng thay đổi. Do đó, tốc độ phân tử mà ta nói tới là tốc độ trung bình của các phân tử. Trong một khối khí có thể có các phân tử chuyển động nhanh hơn, bằng hoặc nhỏ hơn tốc độ trung bình. Người ta nói tốc độ chuyển động của phân tử có tính thống kê và chỉ có ý nghĩa khi có rất nhiều phân tử. Tốc độ này có độ lớn:
\(\overline{\text{v}}=\dfrac{\text{v}_1+\text{v}_2+...+\text{v}_n}{n}\)
Ở điều kiện tiêu chuẩn [T = 273 K (0 oC) và p = 1 atm (105 Pa)], các phân tử khí oxygen chuyển động với tốc độ trung bình vào khoảng 400 m/s.
2. Tương tác giữa các phân tử khí
Giữa các phân tử khí cũng có lực đẩy và lực hút, gọi chung là lực liên kết.
Khoảng cách giữa các phân tử ở thể khí rất lớn so với ở thể lỏng và thể rắn nên lực liên kết giữa các phân tử ở thể khí rất yếu so với ở thể lỏng và thể rắn.
II. MÔ HÌNH ĐỘNG HỌC PHÂN TỬ CHẤT KHÍ
Từ các thí nghiệm và thực tế, người ta đưa ra mô hình động học phân tử chất khí:
1. Chất khí được cấu tạo từ các phân tử có kích thước rất nhỏ so với khoảng cách giữa chúng. Lực liên kết giữa các phân tử ở thể khí rất yếu so với ở thể lỏng và thể rắn.
2. Các phân tử khí chuyển động hỗn loạn, không ngừng. Chuyển động này càng nhanh thì nhiệt độ của khí càng cao.
3. Khi chuyển động hỗn loạn, các phân tử khí va chạm với nhau và với thành bình. Khi va chạm với thành bình các phân tử khí tác dụng lực, gây áp suất lên thành bình.
III. KHÍ LÍ TƯỞNG
Để tìm hiểu các tính chất của chất khí, người ta dùng một mô hình khí đơn giản hơn khí thực (khí tồn tại trong thực tế) nhưng vẫn phản ánh được các đặc điểm cơ bản của khí này:
1. Các phân tử khí được coi là các chất điểm, không tương tác với nhau khi chưa va chạm.
2. Các phân tử khí tương tác khi va chạm với nhau và va chạm với thành bình. Các va chạm này là va chạm hoàn toàn đàn hồi.
Mô hình trên bỏ qua thể tích của phân tử khí, bỏ qua tương tác của các phân tử khi chưa va chạm và coi va chạm là hoàn toàn đàn hồi, giúp việc mô tả các hiện tượng về chất khí trở nên đơn giản, dễ dàng. Chất khí trong mô hình trên gọi là khí lí tưởng.
1. Chất khí được cấu tạo từ các phân tử có kích thước rất nhỏ so với khoảng cách giữa chúng.
2. Các phân tử khí chuyển động hỗn loạn, không ngừng. Chuyển động này càng nhanh thì nhiệt độ của khí càng cao.
3. Khi chuyển động hỗn loạn, các phân tử khí va chạm với nhau và với thành bình. Khi va chạm với thành bình chất khí gây áp suất lên thành bình.
Bạn có thể đăng câu hỏi về bài học này ở đây
