Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Khái niệm về cân bằng hóa học SVIP
I. PHẢN ỨNG MỘT CHIỀU VÀ PHẢN ỨNG THUẬN NGHỊCH
1. Phản ứng một chiều
Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều tạo thành sản phẩm, không xảy ra theo chiều ngược lại.
Biểu diễn bằng mũi tên một chiều (→)
Ví dụ: Phản ứng đốt cháy khí methane trong khí oxygen:
\(CH_4+2O_2\overset{t^{o}}{\rarr}CO_2+2H_2O\)
2. Phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng hóa học xảy ra theo hai chiều ngược nhau, trong đó các chất ban đầu phản ứng tạo thành sản phẩm (chiều thuận), đồng thời sản phẩm cũng có thể biến đổi ngược lại thành chất ban đầu (chiều nghịch) trong cùng điều kiện.
Biểu diễn bằng hai mũi tên ngược chiều: ⇌
Ví dụ: Ở nhiệt độ 445 oC, xảy ra phản ứng thuận nghịch giữa H2 và I2:
\(H_2\left(g\right)+I_2\left(g\right)\rightleftharpoons2HI\left(g\right)\)
Câu hỏi:
@203766400358@
II. CÂN BẰNG HÓA HỌC
1. Trạng thái cân bằng
Phản ứng thuận nghịch đạt trạng thái cân bằng khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
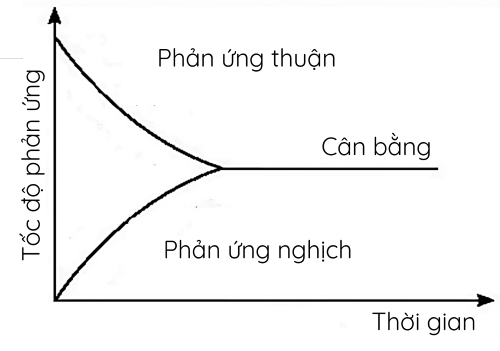
Đồ thị biểu diễn tốc độ phản ứng thuận và phản ứng nghich theo thời gian
- Theo thời gian, tốc độ phản ứng thuận giảm, còn tốc độ phản ứng nghịch tăng. Khi hai tốc độ bằng nhau, hệ đạt trạng thái cân bằng.
- Cân bằng hóa học là cân bằng động, tại đó phản ứng vẫn diễn ra theo hai chiều nhưng nồng độ các chất không thay đổi.
Câu hỏi:
@205827079991@
2. Hằng số cân bằng
a. Biểu thức của hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát:
\(aA+bB\rightleftharpoons cC+dD\)
Biểu thức hằng số cân bằng:
\(K_C=\dfrac{\left[C\right]^c\left[D\right]^d}{\left[A\right]^a\left[B\right]^b}\)
Trong đó:
- [A], [B], [C], [D] là nồng độ chất tại trạng thái cân bằng.
- a, b, c, d là hệ số phản ứng.
Lưu ý: Không biểu diễn nồng độ chất rắn trong biểu thức hằng số cân bằng.
Ví dụ: Xét phản ứng thuận nghịch:
\(H_2\left(g\right)+I_2\left(g\right)\rightleftharpoons2HI\left(g\right)\)
Biểu thức hằng số cân bằng:
\(K_C=\dfrac{\left[HI\right]^2}{\left[H_2\right]\left[I_2\right]}\)
Câu hỏi:
@203766443848@
b. Ý nghĩa của hằng số cân bằng
- Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và bản chất phản ứng.
- KC càng lớn thì phản ứng thuận càng chiếm ưu thế, còn nếu KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế.
III. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN SỰ CHUYỂN DỊCH CÂN BẰNG HÓA HỌC
1. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ, cân bằng hóa học chuyển dịch theo chiều phản ứng thu nhiệt
- Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt.
⚡ THÍ NGHIỆM 1
Nghiên cứu sự ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
\(2NO_2\left(g\right)\rightleftharpoons N_2O_4\left(g\right)\) \(\Delta_{r}H_{298}^{o}<0\)
Chuẩn bị 3 ống nghiệm có chứa khí NO2:
- Ống nghiệm (1): dùng để so sánh.
- Ống nghiệm (2): ngâm trong cốc nước đá.
- Ống nghiệm (3): ngâm trong cốc nước nóng.

⚡ THÍ NGHIỆM 2
Nghiên cứu sự ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
\(CH_3COONa+H_2O\rightleftharpoons CH_3COOH+NaOH\) \(\Delta_{r}H_{298}^{o}>0\)
Chuẩn bị 3 ống nghiệm có chứa 10 mL dung dịch CH3COONa 0,5 M và vài giọt phenolphthalein:
- Ống nghiệm (1): để so sánh.
- Ống nghiệm (2): ngâm trong cốc nước đá.
- Ống nghiệm (3): ngâm trong cốc nước nóng.

Câu hỏi:
@205848081239@
2. Ảnh hưởng của nồng độ
- Khi nồng độ của một chất tăng, cân bằng hóa học chuyển dịch theo chiều làm giảm nồng độ chất đó.
- Khi nồng độ của một chất giảm, cân bằng chuyển dịch theo chiều tạo ra chất đó.
⚡ THÍ NGHIỆM 3
Nghiên cứu sự ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng:
\(CH_3COONa+H_2O\rightleftharpoons CH_3COOH+NaOH\)
Chuẩn bị 3 ống nghiệm chứa dung dịch CH3COONa có chứa sẵn vài giọt phenolphthalein.
- Ống nghiệm (1): Để so sánh.
- Ống nghiệm (2): Thêm vài tinh thể CH3COONa.
- Ống nghiệm (3): Thêm vài giọt dung dịch CH3COOH.

Câu hỏi:
@205848036310@
3. Nguyên lí chuyển dịch cân bằng Le Chatelier
"Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó."
Ví dụ: Trong công nghiệp, ammonia được tổng hợp theo phản ứng:
\(N_2\left(g\right)+3H_2\left(g\right)\rightleftharpoons2NH_3\left(g\right)\) \(\Delta_rH^0_{298}=-98,1\left(kJ\right)\)
- Phản ứng trên có số mol khí giảm từ 4 xuống 2 nên khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí (chiều thuận).
- Phản ứng trên tỏa nhiệt ra môi trường nên khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều thuận.
- Phản ứng trên còn sử dụng xúc tác là bột Fe.
Câu hỏi:
@203862688714@
Bạn có thể đăng câu hỏi về bài học này ở đây
