Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Định luật bảo toàn khối lượng và phương trình hóa học SVIP
1. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
"Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng."
⚡THÍ NGHIỆM 1
- Đặt cốc (1) chứa 30 mL dung dịch barium chloride và cốc (2) chứa 30 mL dung dịch sodium sulfate lên cân và ghi giá trị khối lượng.

- Đổ cốc (1) vào cốc (2) và khuấy nhẹ thì quan sát thấy xuất hiện chất rắn màu trắng ở cốc (2). Đặt cốc (1) trở lại mặt cân và ghi khối lượng.

Câu hỏi:
@203539258696@@205873409148@
- Chất tham gia phản ứng: Barium chloride, sodium sulfate.
- Chất sản phẩm: Barium sulfate, sodium chloride.
Áp dụng định luật bảo toàn khối lượng, ta có:
mBarium chloride + mSodium sulfate = mBarium sulfate + mSodium chloride
2. PHƯƠNG TRÌNH HÓA HỌC
➤ Phương trình hóa học
Phương trình hóa học là dạng biểu diễn phản ứng hóa học thông qua công thức của các chất trước và sau phản ứng.
Trong phương trình hóa học, chất phản ứng được biểu diễn ở bên trái mũi tên (→), sản phẩm ở bên phải mũi tên (→).
Chất phản ứng → Sản phẩm
Ví dụ: Phản ứng giữa khí hydrogen và khí chlorine tạo thành hydrogen chloride.
Sơ đồ phản ứng hóa học dạng chữ:
Hydrogen + Chlorine → Hydrogen chloride
Sơ đồ phản ứng dạng công thức hóa học:
\(H_2+Cl_2--\rarr HCl\)
Thêm hệ số vào trước công thức hóa học để số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
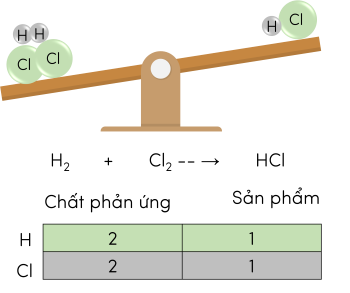

Phương trình hóa học hoàn chỉnh:
\(H_2+Cl_2\rarr2HCl\)
➤ Các bước lập phương trình hóa học
- Bước 1: Viết sơ đồ phản ứng gồm công thức hóa học của chất phản ứng và sản phẩm.
- Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở hai vế bằng cách thêm hệ số thích hợp trước công thức.
- Bước 3: Viết phương trình hóa học đầy đủ.
Ví dụ: Lập phương trình hóa học của phản ứng giữa phosphorus và khí oxygen tạo ra diphosphorus pentoxide.
Bước 1: Viết sơ đồ phản ứng.
\(P+O_2--\rightarrow P_2O_5\)
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố.
- Đặt hệ số 2 vào trước P2O5 để làm chẵn số nguyên tử O ở vế phải.
\(P+O_2--\rightarrow2P_2O_5\)
- Vế phải có 10 O còn vế trái có 2 nên ta thêm 5 vào trước O2.
\(P+5O_2--\rightarrow2P_2O_5\)
- Vế phải có 4 P còn vế trái có 1 nên ta đặt hệ số 4 trước P.
\(4P+5O_2--\rightarrow2P_2O_5\)
Bước 3: Viết phương trình hóa học hoàn chỉnh.
\(4P+5O_2\rightarrow2P_2O_5\)
Lưu ý:
- Khi cân bằng không được thay đổi chỉ số trong những công thức hóa học đã viết đúng.
- Nếu trong công thức hóa học có nhóm nguyên tử (như OH, SO4,…) thì có thể xem cả nhóm là một đơn vị để cân bằng.
Câu hỏi:
@205884606531@
➤ Tìm hiểu ý nghĩa của phương trình hoá học
Phương trình hoá học cho biết tỉ lệ xác định giữa các chất tham gia và sản phẩm trong phản ứng.
Ví dụ: Xét phương trình hoá học:
\(4P+5O_2\rightarrow2P_2O_5\)
Ta có tỉ lệ:
Số phân tử P : Số phân tử O2 : Số phân tử P2O5 = 4 : 5 : 2
⇒ Cứ 4 nguyên tử P tác dụng với 5 phân tử O2 tạo ra 2 phân tử P2O5.
Câu hỏi:
@203539281673@
Bạn có thể đăng câu hỏi về bài học này ở đây
