Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Dãy hoạt động hóa học của kim loại. Một số phương pháp tách kim loại SVIP
1. XÂY DỰNG DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
Dãy hoạt động hóa học của kim loại theo mức độ giảm dần:
K, Na, Ca, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Au
➤ Mô tả thí nghiệm phản ứng của kim loại với nước
- Mẩu sodium phản ứng mạnh với nước.

- Mẩu magnesium không phản ứng với nước ở điều kiện thường và phản ứng chậm với nước nóng.
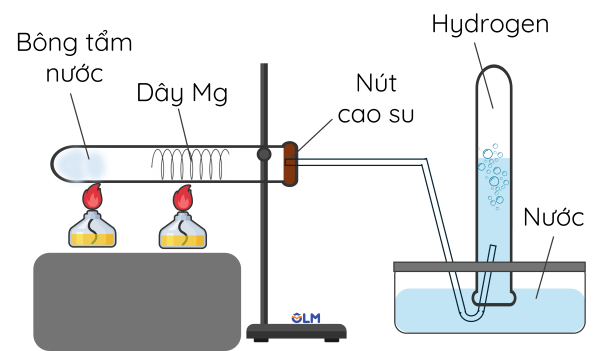
Thí nghiệm magnesium tác dụng với hơi nước
Phương trình hóa học:
\(2Na+2H_2O\rarr2NaOH+H_2\)
\(Mg+H_2O_{\left(hơi\right)}\overset{t^{o}}{\rarr}MgO+H_2\)
Câu hỏi:
@202757916707@
➤ Thí nghiệm phản ứng của kim loại với dung dịch hydrochloric acid
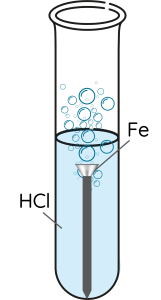
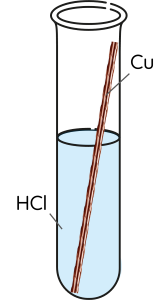
⚡ THÍ NGHIỆM 1
- Ống nghiệm 1: Cho đinh sắt vào dung dịch HCl 1 M.
- Ống nghiệm 2: Cho dây đồng vào dung dịch HCl 1 M.
- Ống nghiệm 3: Cho mẩu magnesium vào dung dịch HCl 1 M.
|
|
|
Câu hỏi:
@202757881622@@202757896774@
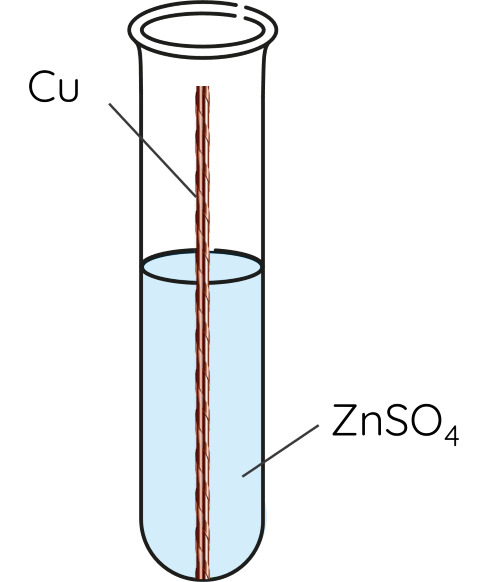
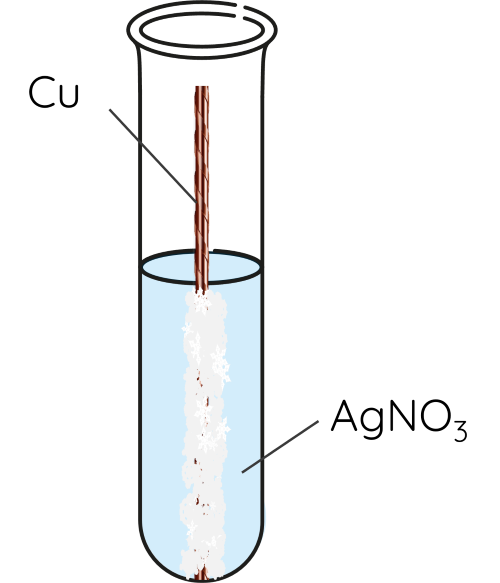
➤ Thí nghiệm phản ứng của kim loại với dung dịch muối
⚡ THÍ NGHIỆM 2
Cho dây đồng vào 2 mL dung dịch ZnSO4 (1) và 2 mL dung dịch AgNO3 (2).
(1) | (2) |
Câu hỏi:
@202682587357@
2. Ý NGHĨA CỦA DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI
- Dãy được sắp xếp theo thứ tự hoạt động hóa học giảm dần từ trái sang phải.
- K, Na, Ca,... là những kim loại hoạt động hóa học mạnh nên có thể phản ứng với nước ở nhiệt độ thường, giải phóng khí H2.
- Kim loại đứng trước H có thể tác dụng với dung dịch acid loãng, sinh ra khí H2.
- Kim loại đứng trước (trừ K, Na, Ca) có thể đẩy kim loại đứng sau ra khỏi dung dịch muối của nó.
Câu hỏi:
@202682663829@
3. TÁCH MỘT SỐ KIM LOẠI CÓ NHIỀU ỨNG DỤNG
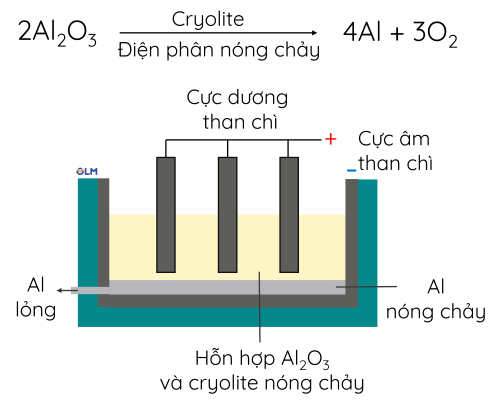
➤ Phương pháp điện phân nóng chảy
Các kim loại hoạt động hóa học mạnh (Na, Mg, Al,...) được tách bằng phương pháp điện phân nóng chảy.
Ví dụ: Tách aluminium oxide (Al2O3) từ quặng bauxite.
Sơ đồ bể điện phân aluminium oxide nóng chảy
➤ Phương pháp nhiệt luyện
Các kim loại hoạt động hóa học trung bình (Zn, Fe,...) được tách bằng phương pháp nhiệt luyện.
Ví dụ: Tách sắt ra khỏi iron(III) oxide.
\(Fe_2O_3+3CO\overset{t^{o}}{\rarr}2Fe+3CO_2\)
Ví dụ: Tách kẽm ra khỏi quặng sphalerite.
- Đốt quặng sphalerite trong không khí:
\(2ZnS+3O_2\overset{t^{o}}{\rarr}2ZnO+2SO_2\)
- Tách kẽm ra khỏi zinc oxide:
\(ZnO+C\overset{t^{o}}{\rarr}Zn+CO\)
Câu hỏi:
@202687465315@
Bạn có thể đăng câu hỏi về bài học này ở đây