Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nguyên tố Mg ở chu kì 3 nhóm IIA.
Nguyên tố Be ở chu kì 2 nhóm IIA.

Tổng điện tích hạt nhân là : 31
\(p_X+p_Y=31\left(1\right)\)
Hai nguyên tố nằm ở hai nhóm kế tiếp nhau cùng chu kì nên :
\(p_X-p_Y=1\left(2\right)\)
\(\left(1\right),\left(2\right):p_X=16,p_Y=15\)
Y: Ô 16 , Chu kì 3 , Nhóm VIA
X : Ô 15 , Chu kì 3 , Nhóm VA

2. Theo dữ kiện bài ra => X là Cl
- Sơ đồ cấu tạo :
- Clo là một chất có tính oxi hóa mạnh. Trong các hợp chất như NaCl, KCl… Clo thường có mức oxi hóa là -1. Tuy nhiên, clo cũng là một chất có tính khử. Tính khử của clo được thể hiện trong trường hợp tác dụng với Oxi. Các mức oxi hóa của clo thường là +1, +3, +5 hay +7…
- Clo có thể tác dụng với kim loại , hidro , nước , muối gốc halogen yếu hơn , chất có tính khử mạnh ,...

NaX + AgNO 3 → NaNO 3 + AgX
a mol a mol a mol a mol
NaY + AgNO 3 → NaNO 3 + AgY
b mol b moi b mol b mol
n AgNO 3 = 0,2 x 150/1000 = 0,O3 mol
m AgNO 3 = 0,3 x 170 = 5,1g
n NaNO 3 = 0,O3 => m NaNO 3 = 0,03 x 85 = 2,55g
Áp dụng định luật bảo toàn khối lượng, ta có :
2,2 + 5,1 = 2,55 + m kết tủa → m kết tủa = 4,75 (gam)
(108 + X)a + (108 + Y)b = 4,75 ; a + b = 0,O3 (mol)
Xa + Yb + 15,1. Cho X > Y ; Xa + Xb > Xa + Yb > Ya + Yb
X > 1,51/0,03 > Y > X > 50,3 > Y
X và Y là các halogen liên tiếp, vậy đó là brom (80) và Cl (35,5).

Gọi công thức chung của 2 kim loại là X
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: X + 2H2O --> X(OH)2 + H2
0,3<-------------------0,3
=> \(M_X=\dfrac{8,8}{0,3}=29,33\left(g/mol\right)\)
Mà 2 kim loại thuộc 2 chu kì liên tiếp nhóm IIA
=> 2 kim loại là Mg(Magie) và Ca(Canxi)
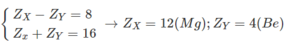
Hai nguyên tố kế tiếp nhau lại thuộc cùng một nhóm A thì nó sẽ cách nhau 8 nguyên tố tức là hơn kém nhau 8e. Mặt khác tổng số p = 24 tức là tổng số e = 24
Gọi số hạt e của nguyên tố X là x Số hạt e của nguyên tố Y là y
Ta có
x - y = 8
x + y = 24
Giải ra tìm đc x=8 và y=16
Số e = STT trong BTH nên X là O còn Y là S
Thuộc cùng nhóm VI A
X là O Y là S
-Tính Chất:
1. Oxi và lưu huỳnh là những nguyên tố phi kim có tính oxi hóa mạnh, trong đó oxi là chất oxi hóa mạnh hơn lưu huỳnh.
- Oxi oxi hóa hầu hết các kim loại (trừ Au, Pt, Ag), nhiều phi kim và nhiều hợp chất hóa học.
Thí dụ : 3Fe + 2O2 -.> Fe3O4
4P + 5O2 -> 2P2O5
C2H5OH + 3O2 -> 2CO2 + 3H2O
-Lưu huỳnh oxi hóa nhiều kim loại và hiđro ở nhiệt độ cao.
2Al + 3S -> Al2S3 ;
H2 + S -> H2S
S + O2 -> SO2.
2. Khác với oxi, lưu huỳnh còn thể hiện tính khử khi tác dụng với những chất có độ âm điện lớn hơn như O, F.