Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.

Đặt X là số oxi hoá của nguyên tố ni tơ trong các hợp chất trên ta có
Trong NO: x + (-2) = 0 -> X = +2
Trong NO2: x + 2(-2) = 0 -> x = +4
Trong N2O5 : 2x + 5(-2) = 0 \(\rightarrow\) x = +5
Trong HNO3 : (+1) + x + 3(-2) = 0 \(\rightarrow\) X = +5
Trong HNƠ2 : (+1) + x + 2(-2) = 0 \(\rightarrow\) X = +3
Trong NH3 : X + 3(+l) = 0 \(\rightarrow\) X = -3
Trong NH4Cl: X + 4(+l) + (-1) = 0 \(\rightarrow\) X = -3.
Cũng giải tương tự như trên ta có:
.jpg)
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2(-2) = 0 → x = +4.
Trong N2O5: 2x + 5(-2) = 0 → x = +5.
Trong HNO3: (+1) +x + 3(-3) = 0 → x = +5.
Trong HNO2: (+1) + x +2(-2) = 0 → x = +3.
Trong NH3 : x + 3(+1) = 0 → x = -3.
Trong NH3Cl: x + 4(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:

Trong các phản ứng trên chỉ có phản ứng C là phản ứng oxi hoá – khử vì có sự thay đổi số oxi hoá của các nguyên tố.

Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng nào không phải là phản ứng oxi hoá - khử ?
Cho các phản ứng sau :
A. Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
B. 2Na + 2H2O → 2NaOH + H2
C. NaH + H2O → NaOH + H2
D. 2F2 + 2H2O → 4HF + O2
Phản ứng A không phải là phản ứng oxi hoá - khử
Vì trong A các nguyên tố không thay đổi số oxh trước và sau phản ứng!!

Đáp án đúng: D. 2NH3 + H2O2 + MnS04 —> Mn02 + (NH4)2SO4.

4 ý cuối :
1)
Cu + 2H2SO4→ CuSO4+ SO2+2H2O
Cu0 →Cu+2 +2e║ x1
S+6+2e →S+4 ║ x1
2)
2Al+ 4H2SO4→ Al2(SO4)3+ S+ 4H2O
2Al0→2Al+3 +6e║x1
S+6 +6e→S0 ║x1
3)
4Zn +5H2SO4→ 4ZnSO4+ H2S+ 4H2O
Zn0\(\rightarrow\) Zn+2 +2e ║x4
S+6 +8e →S−2 ║x1
4)
8Fe+ 15H2SO4→ 4Fe2(SO4)3+3H2S+ 12H2O
2Fe0→ 2Fe+3+6e║x4
S+6 +8e →S−2 ║x3
6 ý đầu
1.\(\overset{-3}{4NH_2}+\overset{0}{5O_2}\rightarrow\overset{+2+6}{4NO}+\overset{-2}{6H_2O}\)
4 X \(||\) N-3 + 5e → N+2
5 X \(||\) 2O0 + 4e → 2O-2
2.\(\overset{-3}{4NH3}+\overset{0}{3O_2}\rightarrow\overset{0}{2N_2}+\overset{-2}{6H_2O}\)
2 X \(||\) 2N-3 + 6e → 2N0
3 X \(||\) 2O0 + 4e → 2O-2
3.\(\overset{0}{3Mg}+\overset{+5}{8NO_3}\rightarrow\overset{+2}{3Mg\left(NO_3\right)_2}+\overset{+2}{2NO}+\overset{ }{4H_2O}\)
3 X \(||\) Mg0 → Mg+2 + 2e
2 X \(||\) N+5 + 3e → N+2
4.\(\overset{0}{Al}+\overset{+5}{6NO_3}\rightarrow\overset{+3}{Al\left(NO_3\right)_3}+\overset{+4}{3NO_2}+\overset{ }{3H_2O}\)
1 X \(||\) Al0 → Al+3 + 3e
3 X \(||\) N+5 + 1e → N+4
5.\(\overset{0}{Zn}+\overset{+5}{4HNO_3}\rightarrow\overset{+3}{Fe\left(NO_3\right)_3}+\overset{+2}{NO}+\overset{ }{2H_2O}\)
1 X \(||\) Zn0 → Mg+2 + 2e
2 X \(||\) N+5 + 3e → N+4
6.\(\overset{0}{Fe}+\overset{+5}{4HNO_3}\rightarrow\overset{+3}{Fe\left(NO_3\right)_3}+\overset{+2}{NO}+\overset{ }{2H_2O}\)
1 X \(||\) Fe0 → Fe+3 + 3e
1 X \(||\) N+5 + 3e → N+2
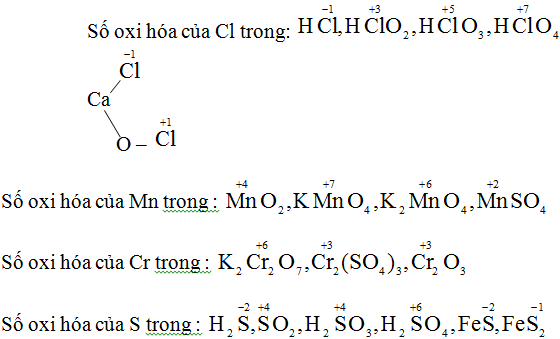
.jpg)
.jpg)

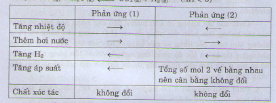
Chọn đáp án B
Muốn cân bằng không dịch chuyển khi tăng áp thì tổng số mol khí không đổi sau phản ứng:
1) Fe2O3(r) + 3CO(k) ⇌ 2Fe(r) + 3CO2(k) (Thỏa mãn 3 =3 )
2) CaO(r) + CO2(k) ⇄ CaCO3(r) (Không thỏa mãn 1 ≠0)
3) N2O4(k) ⇄ 2NO2(k) (Không thỏa mãn 1 ≠2)
4)H2(k) + I2(k) ⇄ 2HI(k) (Thỏa mãn 2 =2 )
5) 2SO2(k) + O2(k) ⇄ 2SO3(k) (Không thỏa mãn 3 ≠2)