Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHCl = 5.0,5 = 2,5 (mol)
⇒ mHCl = 2,5.36,5 = 91,25 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{91,25}{36\%}=\dfrac{9125}{36}\left(g\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{\dfrac{9125}{36}}{1,19}\approx213\left(ml\right)=0,213\left(l\right)\)

\(a) n_{Zn} = \dfrac{19,5}{65} = 0,3(mol) ; n_{HCl} = 0,35.2 = 0,7(mol)\\ Zn + 2HCl \to ZnCl_2 + H_2\\ n_{HCl} = 0,7 > 2n_{Zn} = 0,6 \to HCl\ dư\\ n_{H_2} = n_{Zn} = 0,3(mol) \Rightarrow V_{H_2} = 0,3.22,4 = 6,72(lít)\\ b) m_{dd\ HCl} = 350.1,05 = 367,5(gam)\\ m_{dd\ sau\ pư} = 19,5 + 367,5 - 0,3.2 = 386,4(gam)\\ \Rightarrow C\%_{ZnCl_2} = \dfrac{0,3.136}{386,4}.100\% = 10,56\%\\ c) C\%_{HCl} = \dfrac{0,7.36,5}{367,5}.100\% = 6,95\%\)

\(n_{Na_2CO_3}=n_{Na_2CO_3\cdot10H_2O}=\dfrac{57.2}{106+18\cdot10}=0.2\left(mol\right)\)
\(C_{M_{Na_2CO_3}}=\dfrac{0.2}{0.4}=0.5\left(M\right)\)
\(m_{Na_2CO_3}=0.2\cdot106=21.2\left(g\right)\)
\(m_{dd}=400\cdot1.05=420\left(g\right)\)
\(C\%_{Na_2CO_3}=\dfrac{21.2}{420}\cdot100\%=5.04\%\)

* Phương pháp xác định nồng độ phần trăm dung dịch C u S O 4
- Cân một lượng dung dịch C u S O 4 xác định.
- Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng đó là C u S O 4 . Sau đó đem cân lượng muối sau khi cô cạn này ta được số liệu là mct.
- Áp dụng công thức: 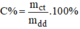 ta sẽ tính C% của dung dịch
C
u
S
O
4
.
ta sẽ tính C% của dung dịch
C
u
S
O
4
.
* Phương pháp xác định nồng độ mol của dung dịch C u S O 4 :
- Đong 1 thể tích dung dịch C u S O 4 xác định, đem cân lượng dung dịch đó.
- Sau đó dùng công thức 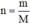 để tính số mol của
C
u
S
O
4
.
để tính số mol của
C
u
S
O
4
.
- Tính nồng độ mol của dung dịch
C
u
S
O
4
bằng công thức: 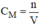

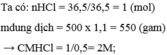
mHCl =?
Dung dịch HCl 10,8M → Trong 1 lít dd HCl 10,8M có 10,8 (mol) HCl.
Ta có: mHCl (trong 1 lít dd HCl 10,8M) = 10,8.36,5 = 394,2 (g)
m dd HCl 10,8M = 1000.1,19 = 1190 (g)
\(\Rightarrow C\%_{HCl\left(10,8M\right)}=\dfrac{394,2}{1190}.100\%\approx33,126\%\)