Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,
Dẫn 3 khí qua brom. Etilen làm mấy màu brom.
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Đưa que đóm tàn đỏ vào 2 khí còn lại. O2 làm bùng que đóm, metan thì ko.
b,
Dẫn 3 khí qua brom. Etilen làm mấy màu brom.
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Đưa CuO nóng đỏ vào 2 khí còn lại. H2 khử CuO từ đen sang đỏ. Còn lại là metan.
\(H_2+CuO\rightarrow Cu+H_2O\)
c,
Dẫn 3 khí qua brom. Axetilen làm mấy màu brom.
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Dẫn 2 khí còn lại qua dd Ca(OH)2 dư. CO2 làm đục nước vôi, metan thì ko.
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
d,
Dẫn 4 khí qua dd Ca(OH)2 dư. CO2 làm đục nước vôi.
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Đưa que đóm tàn đỏ vào 3 khí còn lại. O2 làm que đóm bùng cháy.
Đưa CuO nóng đỏ vào 2 khí còn lại. H2 khử CuO từ đen sang đỏ. Còn lại là metan.
\(H_2+CuO\rightarrow Cu+H_2O\)

a/
dẫn các khí qua dd brom
+ khí làm dd brom mất màu nhanh là C2H2
C2H2+ 2Br2\(\rightarrow\) C2H2Br4
+ khí làm dd brom mất màu chậm là C2H4
C2H4+ Br2\(\rightarrow\) C2H4Br2
+ khí không làm mất màu dd brom là CH4 và CO2
để phân biệt CH4 và CO2 ta dẫn 2 khí qua bình đựng dd nước vôi trong
+ khí làm nước vôi vẩn đục là CO2
CO2+ Ca(OH)2\(\rightarrow\) CaCO3\(\downarrow\)+ H2O
+ khí không làm vẩn đục nước vôi trong là CH4
c/
dẫn từng khí qua bình đựng dd nước vôi trong
+ khí làm nước vôi vẩn đục là SO2
SO2+ Ca(OH)2\(\rightarrow\) CaSO3\(\downarrow\)+ H2O
+ khí không làm nước vôi vẩn đục là CH4 và C2H4
để phân biệt CH4 và C2H4 ta dẫn từng khí qua dd brom
+ khí làm mất màu dd brom là C2H4
C2H4+ Br2\(\rightarrow\) C2H4Br2
+ khí không là mất màu nước brom là CH4

Mk chỉ bt nhận bt cách nhận bt cacbonic thôi. a,Cho lần lượt các khí vào một cốc chứa nước vôi trong nếu chất nào làm đục nước vôi trong thì chất đó là cacbonic

\(CH_4+Cl_2\xrightarrow[]{a/s}CH_3Cl+HCl\\ CH_2=CH_2+Br_2\rightarrow CH_2Br-CH_2Br\\ CH\equiv CH+2Br_2\rightarrow CHBr_2-CHBr_2\\ CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\\ C_2H_4+3O_2\xrightarrow[]{t^o}2CO_2+2H_2O\\ 2C_2H_2+5O_2\xrightarrow[]{t^o}4CO_2+2H_2O\\ nCH_2=CH_2\xrightarrow[]{t^o,p,xt}\left(-CH_2-CH_2-\right)_n\)

Câu 1: Hoàn thành các PTHH sau:
a. CH4 + 2O2 to→CO2+2H2O
b. CH4 + Cl2 ás→CH3Cl+HCl
c. C2H4 +3 O2 to→2CO2+2H2O
d. C2H4 + Br2 →C2H4Br2
e. nC2H4 to→-(-CH2-CH2-)-n
f. C2H2 + Br2 →C2H2Br2
g. C2H2 + \(\dfrac{5}{2}\)O2 to→2CO2+H2O
h.C2H2 + 2Br2 →C2C2Br4
Theo mình bạn nên tách ra thành nhiều câu và sẽ thuận tiện hơn.

Dẫn hỗn hợp khí qua bình đựng dung dịch brom dư, khí etilen phản ứng hết tạo thành đibrometan là chất lỏng ở trong dung dịch. Khí thoát ra là CH4.
CH2 = CH2 + Br2 → Br-CH2-CH2-Br
Dẫn hỗn hợp khí qua bình đựng dung dịch brom dư, khí etilen phản ứng hết tạo thành đibrometan là chất lỏng ở trong dung dịch. Khí thoát ra là CH4.
CH2 = CH2 + Br2 → Br-CH2-CH2-Br

a, Bảng nhận biết:
| CH4 | CO2 | C2H4 | |
| dd Br2 | Không hiện tượng | Không hiện tượng | dd Br2 mất màu |
| dd Ca(OH)2 | Không hiện tượng | Kết tủa trắng | Đã nhận biết |
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow\left(trắng\right)+H_2O\)
a, Trích mẫu thử từng chất rồi đánh số. Dẫn các khí qua dd brom:
+ Khí làm dung dịch brom mất màu là khí etilen: C2H4
PTHH: C2H4 + Br2 → C2H4Br2
+ Khí không làm mất màu dung dịch brom là: CH4 và CO2
Để phân biệt CH4 và CO2, ta dẫn 2 khí qua bình đựng dung dịch nước vôi trong:
+ Khí làm nước vôi vẩn đục là cacbonic: CO2
PTHH: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
+ Khí không làm vẩn đục nước vôi trong là CH4
b,Trích mẫu thử từng chất rồi đánh số. Cho các mẫu thử tác dụng với quỳ tím. Quỳ tím hóa đỏ là axit axetic. Quỳ tím không đổi màu là rượu etylic và dầu ăn. Tiếp theo cho 2 mẫu thử còn lại vào nước. Mẫu thử tan trong nước là rượu etylic, mẫu thử còn lại không tan là dầu ăn.

Tính chất hoá học của Metan CH4
1. Metan tác dụng với oxi:
- Khi đốt trong oxi, metan cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
CH4 + 2O2 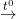 CO2 + 2H2O
CO2 + 2H2O
2. Metan tác dụng với clo khi có ánh sáng
CH4 + Cl2 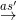 HCl + CH3Cl (metyl clorua)
HCl + CH3Cl (metyl clorua)
- Ở phản ứng này, nguyên tử H của metan được thay thế bởi nguyên tử Cl, vì vậy còn được gọi là phản ứng thế.
Tính chất hoá học của etilen C2H4
1) Etilen C2H4 Tác dụng với oxi:
- Khi đốt trong oxi, etilen cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
C2H4 + 3O2 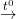 2CO2↑ + 2H2O
2CO2↑ + 2H2O
2) Etilen C2H4 tác dụng với dung dịch Brom
- Dung dịch Brom hay nước Brom có màu vàng da cam; Ở phản ứng này, một liên kết kém bền trong liên kết dôi bị đứt ra và phân tử etilen kết hợp thêm một phân tử brom. Phản ứng trên gọi là .hàn ứng cộng.
CH2=CH2 + Br2 (dd) → Br-CH2-CH2-Br
- Ngoài Brom, trong những điều kiện thích hợp, etilen còn có phản ứng cộng vởi một số chất khác, như hiđro,...
3. Phản ứng trùng hợp của etilen C2H4
- Khi có xúc tác và nhiệt độ thích hợp, liên kết kém bền trong phân tử etilen bị dứt ra làm cho các phân tử etilen kết hợp với nhau, tạo thành chất có phân tử lượng rất lớn gọi là polime.
...+ CH2=CH2 + CH2=CH2 + CH2=CH2 + ... ![small xrightarrow[t^{0},P]{xt}](https://hayhochoi.vn/uploads/news/wyswyg/2019_01/giflatexsmallspacexrightarrowt0p_1548216818.gif) ...- CH2- CH2- CH2- CH2- CH2- CH2-...
...- CH2- CH2- CH2- CH2- CH2- CH2-...
- Phản ứng trên được gọi là phản ứng trùng hợp, polietilen (PE) là chất rắn, không độc, không tan trong nước và là nguyên liệu quan trọng trong công nghiệp chất dẻo.
Tính chất hoá học của Axetilen (C2H2)
1. Axetilen tác dụng với Oxi
- Khi đốt trong không khí, axetilen cháy với ngọn lửa sáng, tỏa nhiều nhiệt
2C2H2 + 5O2 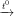 4CO2↑ + 2H2O
4CO2↑ + 2H2O
2. Axetilen tác dụng với dung dịch brom
- Trong liên kết ba  của phân tử axetilen có 2 liên kết kém bền, vì vậy axetilen cũng làm mất màu dung dịch brom như etilen theo PTPƯ sau:
của phân tử axetilen có 2 liên kết kém bền, vì vậy axetilen cũng làm mất màu dung dịch brom như etilen theo PTPƯ sau:
HC CH + Br2 —> Br-CH=CH—Br (đibrom etilen)
CH + Br2 —> Br-CH=CH—Br (đibrom etilen)
Br-CH=CH-Br + Br2 —> Br2CH-CHBr2 (tetra brometan)
- Nếu nước brom lấy dư và axetilen phản ứng hết:
HC CH + 2Br2 —> Br2CH-CHBr2
CH + 2Br2 —> Br2CH-CHBr2
- Trong điều kiện thích hợp, axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2,...
| Metan | Etilen | Axetilen | Benzen | |
| Công thức cấu tạo |  |  |  |  |
| Đặc điểm cấu tạo | Có 4 liên kết đơn σ giữa C và H | Có 1 liên kết đôi π giữa 2 nguyên tử C | Có 1 liên kết 3 (1 σ và 2 π) giữa 2 nguyên tử C | Vòng 6 cạnh, 3 liên kết đôi π xen kẽ giữa 3 liên kết σ đơn |
| Phản ứng đặc trưng | Phản ứng thế phản ứng hidro hóa | Phản ứng cộng | Phản ứng cộng | Phản ứng thế và phản ứng cộng |
| Ứng dụng chính | Làm nhiên liệu trong đời sống và sản xuất | Làm nguyên liệu sản xuất rượu etylic và axit axetic | Làm nguyên liệu trong công nghiệp và sản xuất 1 số chất hưu cơ khác | Làm dung môi và làm nguyên liệu sản xuất 1 số chất dẻo. |
• Một số phản ứng đặc trưng của Axetilen , Etilen , Benzen và Metan
CH4 + Cl2  CH3Cl + HCl
CH3Cl + HCl
C2H4 (khí) + Br2(dd) → CH2Br-CH2Br (lỏng)
C2H2 (khí) + Br2(dd) → Br2-CH-CH-Br2 (lỏng)
C6H6 (khí) + Br2(lỏng) → C6H5Br(lỏng) + HBr (khí)
a, \(CH_4+Cl_2\rightarrow CH_3Cl\uparrow+HCl\uparrow\)
b,\(C_2H_4+H_2\rightarrow C_2H_6\uparrow\)
c, \(C_2H_4+HCl\rightarrow C_2H_5Cl\)
d,\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
e, \(C_2H_4\underrightarrow{^{^X}}\)
f,\(CH_4+O_2\rightarrow CO_2\uparrow+2H_2O\)
g,\(C_2H_4+2O_2\rightarrow CO_2\uparrow+2H_2O\)