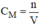Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Refer.
Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
\(C\%=\dfrac{8}{100}\cdot100\%=8\%\)
Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
\(n_{CuSO_4}=\dfrac{8}{160}=0.05\left(mol\right)\)
– Tính nồng độ mol của dung dịch CuSO4 :
\(C_M=\dfrac{1000\cdot0.05}{90}=0.56\left(M\right)\)

1. Đốt nóng KMnO4 ở t độ cao:
\(2KMnO_4\rightarrow^{t^0}K_2MnO_4+MnO_2+O_2\uparrow\)
2. Cho Zn vào đ HCl thu được:
\(Zn+HCl\rightarrow ZnCl_2+H_2\uparrow\)
3. Thu O2: đẩy kk hoặc đẩy nước (Xem SGK)
Thu H2: đẩy nước hoặc đẩy kk (Xem SGK)
1 , nhiệt phân \(KMnO_4\)
\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)

Ta lấy khoảng 50ml dung dịch NaCl cho vào bình chứa. Cân khoảng 1g NaCl tinh khiết cho vào bình đựng dung dịch NaCl và lắc kỹ 1 thời gian. Nếu:
- Có hiện tượng NaCl bị hóa tan 1 ít hoặc hoàn toàn, ta kết luận dung dich ban đầu chưa bão hòa ở nhiệt độ thường.
- Không thấy hiện tượng gì xảy ra, ta kết luận dung dịch NaCl ban đầu đã bão hòa ở nhiệt độ phòng.

Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)

Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)

* Phương pháp xác định nồng độ phần trăm dung dịch C u S O 4
- Cân một lượng dung dịch C u S O 4 xác định.
- Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng đó là C u S O 4 . Sau đó đem cân lượng muối sau khi cô cạn này ta được số liệu là mct.
- Áp dụng công thức: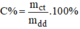 ta sẽ tính C% của dung dịch
C
u
S
O
4
.
ta sẽ tính C% của dung dịch
C
u
S
O
4
.
* Phương pháp xác định nồng độ mol của dung dịch C u S O 4 :
- Đong 1 thể tích dung dịch C u S O 4 xác định, đem cân lượng dung dịch đó.
- Sau đó dùng công thức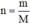 để tính số mol của
C
u
S
O
4
.
để tính số mol của
C
u
S
O
4
.
- Tính nồng độ mol của dung dịch C u S O 4 bằng công thức: