Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)nMgO=6:40=0,15(mol)
Ta có PTHH:
MgO+H2SO4->MgSO4H2O
0,15......0,15...........0,15..................(mol)
Theo PTHH:mH2SO4=0,15.98=14,7g
b)Ta có:mddH2SO4=D.V=1,2.50=60(g)
=>Nồng độ % dd H2SO4 là:
C%ddH2SO414,7\60.100%=24,5%
c)Theo PTHH:mMgSO4=0,15.120=18(g)
Khối lượng dd sau pư là:
mddsau=mMgO+mddH2SO44=6+60=66(g)
Vậy nồng độ % dd sau pư là:
C%ddsau=18\66.100%=27,27%

a)nMgO=0,15(mol)
Ta có PTHH:
MgO+H2SO4->MgSO4+H2O
0,15......0,15...........0,15..................(mol)
Theo PTHH:mH2SO4=0,15.98=14,7g
b)Ta có:mddH2SO4=1,2.50=60(g)
=>Nồng độ % dd H2SO4là:
C%ddH2SO4=\(\dfrac{14,7}{60}100\)=24,5%
c)Theo PTHH:mMgSO4=0,15.120=18(g)
Khối lượng dd sau pư là:
mddsau=6+60=66(g)
Vậy nồng độ % dd sau pư là:
C%ddsau=\(\dfrac{18}{66}.100\)=27,27%

a)\(n_{MgO}\)=6:40=0,15(mol)
Ta có PTHH:
MgO+\(H_2SO_4\)->MgS\(O_4\)+\(H_2O\)
0,15......0,15...........0,15..................(mol)
Theo PTHH:\(m_{H_2SO_4}\)=0,15.98=14,7g
b)Ta có:\(m_{ddH_2SO_4}\)=D.V=1,2.50=60(g)
=>Nồng độ % dd \(H_2SO_4\) là:
\(C_{\%ddH_2SO_4}\)=\(\dfrac{14,7}{60}\).100%=24,5%
c)Theo PTHH:\(m_{MgSO_4}\)=0,15.120=18(g)
Khối lượng dd sau pư là:
\(m_{ddsau}\)=\(m_{MgO}\)+\(m_{ddH_2SO_4}\)=6+60=66(g)
Vậy nồng độ % dd sau pư là:
\(C_{\%ddsau}\)=\(\dfrac{18}{66}\).100%=27,27%

a)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)Số mol của kẽm là:
\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ : 1 1 1 1 (mol)
số mol : 0,15 0,15 0,15 0,15 (mol)
Khối lượng H2SO4 tham gia phản ứng là:
\(m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
c)Khối lượng của dung dịch H2SO4 là:
\(m_{ddH_2SO_4}=D.V_{dd}=500.1,2=600\left(g\right)\)
Nồng độ phần trăm của dung dịch H2SO4 là:
\(C_{\%H_2SO_4}=\dfrac{m_{H_2SO_4}}{m_{ddH_2SO_4}}.100\%=\dfrac{14,7}{600}.100\%=2,45\%\)
d) Khối lượng của khí H2 là:
\(m_{H_2}=0,15.2=0,3\left(g\right)\)
Khối lượng của ZnSO4 là:
\(m_{ZnSO_4}=0,15.161=24,15\left(g\right)\)
Khối lượng của dung dịch ZnSO4 là:
\(m_{ddZnSO_4}=9,75+600-0,3=609,45\left(g\right)\)
Nồng độ dung dịch của muối sau phản ứng là:
\(C_{\%ZnSO_4}=\dfrac{m_{ZnSO_{\text{4}}}}{m_{ddZnSO_4}}.100\%=\dfrac{24,15}{609,45}.100\%=3,9\%\)

\(Na+H_2O->NaOH+\dfrac{1}{2}H_2\\ a.n_{Na}=\dfrac{m_1}{23}\left(mol\right)\\ m_{ddsau}=\dfrac{m_1}{23}+m_2-\dfrac{m_1}{46}=\dfrac{m_1}{46}+m_2\left(g\right)\\ C\%_B=\dfrac{\dfrac{40}{23}m_1}{\dfrac{m_1}{46}+m_2}\cdot100\%.\\ b.C_M=\dfrac{10dC\%}{M}=10\cdot1,2\cdot\dfrac{0,05}{40}=0,015\left(M\right)\)
\(Na+H_2O->NaOH+\dfrac{1}{2}H_2\\ a.n_{Na}=\dfrac{m_1}{23}\left(mol\right)\\ m_{ddsau}=m_1+m_2-\dfrac{m_1}{23}=\dfrac{22}{23}m_1+m_2\left(g\right)\\ C\%_B=\dfrac{\dfrac{40}{23}m_1}{\dfrac{22}{23}m_1+m_2}\cdot100\%.\\ b.C_M=\dfrac{10dC\%}{M}=10\cdot1,2\cdot\dfrac{0,05}{40}=0,015\left(M\right)\)

Bài 1:
\(a.n_{NaOH\left(tổng\right)}=0,05.1+0,2.0,2=0,09\left(mol\right)\\ V_{ddNaOH\left(tổng\right)}=50+200=250\left(ml\right)=0,25\left(l\right)\\ C_{MddNaOH\left(cuối\right)}=\dfrac{0,09}{0,25}=0,36\left(M\right)\\ b.n_{HCl}=0,5.0,02=0,01\left(mol\right)\\ n_{H_2SO_4}=0,08.0,2=0,016\left(mol\right)\\ V_{ddsau}=20+80=100\left(ml\right)=0,1\left(l\right)\\ C_{MddH_2SO_4}=\dfrac{0,016}{0,1}=0,16\left(M\right)\\ C_{MddHCl}=\dfrac{0,01}{0,1}=0,1\left(M\right)\)
Bài 2:
\(a.m_{H_2SO_4}=29,4.10\%=2,94\left(g\right)\\ b.n_{H_2SO_4}=\dfrac{2,94}{98}=0,03\left(mol\right)\\ n_{Fe}=\dfrac{0,56}{56}=0,01\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Vì:\dfrac{0,01}{1}< \dfrac{0,03}{1}\Rightarrow H_2SO_4dư\\ n_{H_2SO_4\left(dư\right)}=0,03-0,01=0,02\left(mol\right)\\ m_{H_2SO_4\left(dư\right)}=0,02.98=1,96\left(g\right)\\ n_{H_2}=n_{Fe}=0,01\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=0,01.22,4=0,224\left(l\right)\)

Ta có: V A : V B = 2:3
Số mol H 2 S O 4 có trong 2V (l) dung dịch A:
n H 2 S O 4 = C M . V A = 0,2 . 2V = 0,4V (mol)
Số mol H 2 S O 4 có trong 3V (l) dung dịch B:
n H 2 S O 4 = C M . V B = 0,5 . 3V = 1,5V (mol)
Nồng độ mol của dung dịch H 2 S O 4 sau khi pha trộn:
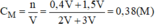
Vậy nồng độ mol của dung dịch C là 0,38M.