Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có:\(\text{ nKMnO4=0,1.0,2=0,02 mol}\)
\(\text{nK2Cr2O7=0,1.0,1=0,01 mol}\)
Bảo toàn e:
nFeSO4=5nKMnO4 + 6nK2Cr2O7\(\text{=0,02.5+0,01.6=0,16 mol}\)
\(\rightarrow\)V dung dịch FeSO4=\(\frac{0,16}{0,5}\)=0,32 lít

cho mình hỏi tại sao là chia thành 0,4a mol với 0,6 vậy

Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 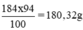
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 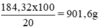
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.

a) Giả sử lấy lượng mỗi chất là a gam
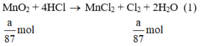
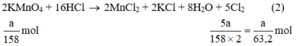
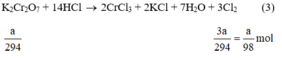
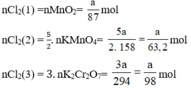
Ta có: 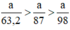
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 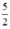 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.

\(n_{K2Cr2O7}=\frac{58,8}{294}=0,2\left(mol\right)\)
\(m_{Dd_{HCl}}=200.1,095=219\left(g\right)\)
\(\rightarrow n_{HCl}=\frac{219.37\%}{36,5}=2,22\left(mol\right)\)
\(PTHH:K_2Cr_2O_7+14HCl\rightarrow2KCl+2CrCl_3+3Cl_2+7H_2O\)
___________0,2 _______2,22______________________________
Ta có \(\frac{0,2}{1}>\frac{2,22}{14}\)
Nên HCl hết trước
Suy ra hiệu suất tính theo HCl
Gọi số mol HCL phản ứng là a
Ta có\(\frac{a}{2,22}=75\%\)
\(\rightarrow a=1,665\)
\(\rightarrow n_{Cl2}=\frac{1,665.3}{14}=\frac{999}{2800}\)
\(\rightarrow V_{CL2}=\frac{999}{2800.22,4}=7,992\left(l\right)\)

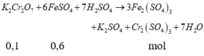
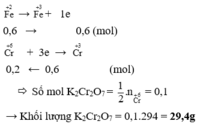


\(n_{K_2Cr_2O_7}=0,2\cdot0,1=0,02mol\)
\(\Rightarrow m_{K_2Cr_2O_7}=0,02\cdot294=5,88g\)