Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
- Xét phản ứng đốt cháy 1 mol C2H4
C2H4 (g) + 3O2 (g) → 2CO2 (g)+ 2H2O (g)
∆fH0298 = 1 x Eb (C2H4) + 3 x Eb (O2) - 2 x Eb (CO2) - 2 x Eb (H2O)
∆fH0298 = 1 x EC=C + 4 x EC-H + 3 x EO2 – 2 x 2EC=O – 2 x 2EO-H
∆fH0298 = 1x611 + 4x414 + 3x498 – 2x2x799 – 2x2x464 = -1291kJ
- Xét phản ứng đốt cháy 1 mol C2H6
C2H6 (g) + 7/2 O2 (g) → 2CO2 (g)+ 3H2O (g)
∆fH0298 = 1 x Eb (C2H6) + 7/2 x Eb (O2) - 2 x Eb (CO2) - 3 x Eb (H2O)
∆fH0298 = 1 x EC-C + 6 x EC-H + 7/2 x EO2 – 2 x 2EC=O – 3 x 2EO-H
∆fH0298 = 1x347 + 6x414 + 7/2 x498 – 2x2x799 – 3x2x464 = -1406kJ
- Xét phản ứng đốt cháy 1 mol CO
CO(g) + ½ O2 (g) → CO2(g)
∆fH0298 = 1 x Eb (CO) + 1/2 x Eb (O2) - 1 x Eb (CO2)
∆fH0298 = 1 x ECO + 1/2 x EO2 – 1 x 2EC=O
∆fH0298 = 1 x 1072 + 1/2 x 498– 1x2x799 = -277kJ
b)
F2(g) + H2O(g) → 2HF(g) + ½ O2 (g)
∆fH0298 = 1 x Eb (F2) + 1 x Eb (H2O) - 2 x Eb (HF) – 1/2 x Eb (O2)
∆fH0298 = 1 x EF-F + 1x2EO-H - 2 x EH-F - 1/2 x EO2
∆fH0298 = 1 x 159 + 2x464– 2x565 - 1/2 x 498= -292kJ
Các phản ứng trên đều có giá trị elthanpy âm => Các phản ứng trên đều thuận lợi

A: H2
B: HCl
C: FeCl2
D: FeCl3
E: NaOH
F: Fe(OH)3
G: Fe2O3
H: H2O
PTHH:
(1): Cl2 + H2 =(nhiệt)=> 2HCl
(2): 2HCl + Fe ===> FeCl2 + H2
(3): 2FeCl2 + Cl2 ===> 2FeCl3
(4): FeCl3 + 2NaOH ===> Fe(OH)3\(\downarrow\) + 2NaCl
(5): 2Fe(OH)3 =(nhiệt)=> Fe2O3 + 3H2O
(6): Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O

a)Phản ứng sản xuất NH3 là phản ứng tỏa nhiệt, lượng nhiệt tỏa ra dùng để đốt nóng hỗn hợp N2 và H2 cho phản ứng tiếp tục xảy ra
=> Tiết kiệm nhiên liệu đốt cho quá trình phản ứng
b) N2(g) + 3H2(g) → 2NH3(g) ${\Delta _r},H_{298}^0$= -92,22 kJ
Ta có: -92,22 = 2 x ∆fH0298 (NH3) – 1 x ∆fH0298 (N2) - 3 x ∆fH0298 (H2)
=> -92,22 = 2 x ∆fH0298 (NH3) – 0 – 0
=> ∆fH0298 (NH3) = -46,11 kJ

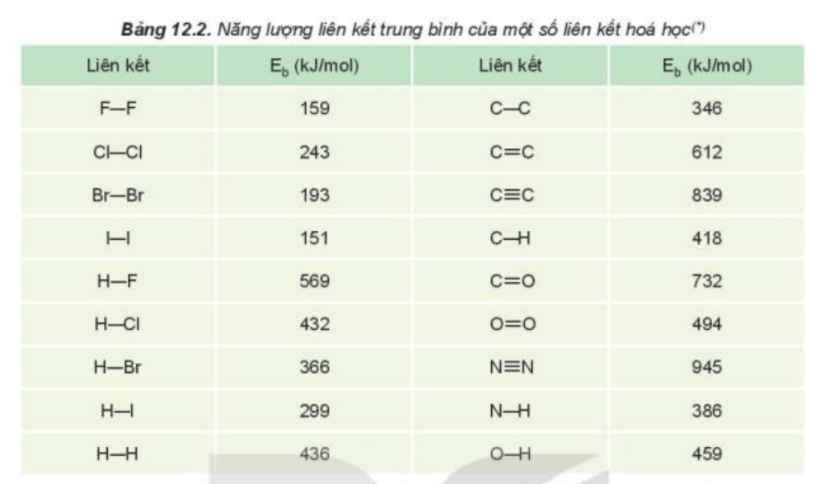
Năng lượng càng lớn thì liên kết đó càng bền.
=> Đáp án C.

Giả sử: 1 gam C và Al
+ 1 gam C có 1/12 mol
1 mol C : ${\Delta _r},H_{298}^0$ = -393,5 kJ
1/12 mol C ${\Delta _r},H_{298}^0$ = -32,79 kJ
+ 1 gam Al có 1/27 mol
2 mol Al : ${\Delta _r},H_{298}^0$= -1675,7 kJ
1/27mol Al : ${\Delta _r},H_{298}^0$= -31,03 kJ
⇒ Với cùng một khối lượng C và Al, C khi đốt cháy tỏa ra nhiều nhiệt hơn.

1.
- Từ F2 đến I2, tính oxi hóa của các halogen giảm dần
=> Khả năng hoạt động của các đơn chất halogen giảm dần
=> Xu hướng phản ứng với hydrogen giảm dần
2.
- Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần
=> Khả năng halogen liên kết với hydrogen giảm dần
=> Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2
Giá trị ${\Delta _r}H_{298}^0$ của phản ứng sau là bao nhiêu kJ?
½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l)

½ CH4(g) + O2(g) → ½ CO2(g) + H2O(l) ${\Delta _r}H_{298}^0 = \frac{{ - 890,36}}{2} = - 445,18kJ$
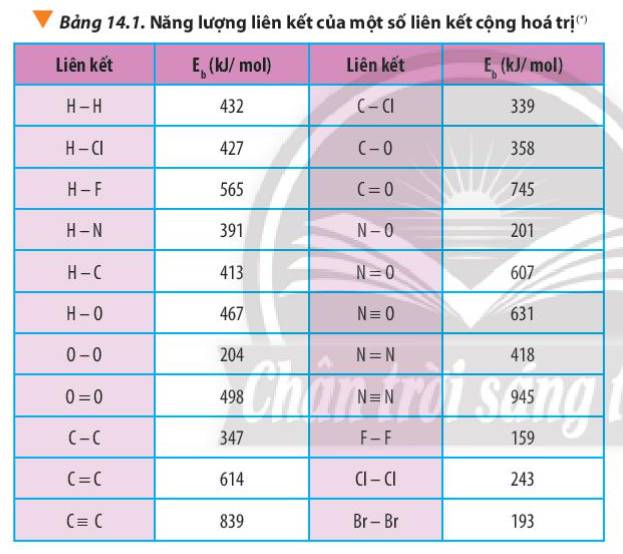
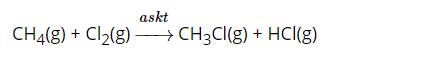


- Xét X là F:
CH4(g) + F2(g) → CH3F(g) + HF(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (F2) - 1 x Eb (HF) - x Eb (CH3F)
∆rH0298 = 1 x 4EC-H + 1 x EF-F - 1 x EH-F - 1 x (3EC-H + EC-F)
∆rH0298 = 1x4 x414 + 1x159– 1x565 - 1x(3x414 + 1x485)= -477kJ
- Xét X là Cl:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Cl2) - 1 x Eb (HCl) - x Eb (CH3Cl)
∆rH0298 = 1 x 4EC-H + 1 x ECl-Cl - 1 x EH-Cl - 1 x (3EC-H + EC-Cl)
∆rH0298 = 1x4 x414 + 1x243– 1x431 - 1 x(3x414 + 1x339)= -113kJ
- Xét X là Br:
CH4(g) + Br2(g) → CH3Br(g) + HBr(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (Br2) - 1 x Eb (HBr) - x Eb (CH3Br)
∆rH0298 = 1 x 4EC-H + 1 x EBr-Br - 1 x EH-Br - 1 x (3EC-H + EC-Br)
∆rH0298 = 1x4 x414 + 1x193– 1x364 - 1 x(3x414 + 1x276)= -33kJ
- Xét X là I:
CH4(g) + I2(g) → CH3I(g) + HI(g)
∆rH0298 = 1 x Eb (CH4) + 1 x Eb (I2) - 1 x Eb (HI) - x Eb (CH3I)
∆rH0298 = 1 x 4EC-H + 1 x EI-I - 1 x EH-I - 1 x (3EC-H + EC-I)
∆rH0298 = 1x4 x414 + 1x151– 1x297 - 1 x(3x414 + 1x240)= 28kJ
=> Từ F đến I, tính phi kim giảm dần nên khả năng tham gia phản ứng giảm dần