Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn có thể làm rõ rõ một chút được không ạ ?? Mình cảm ơn.

Do ở 2 TN, lượng CO2 thu được khác nhau
=> HCl hết trong cả 2 TN
TN1:
Na2CO3 + HCl --> NaCl + NaHCO3
a----------->a---------------->a
NaHCO3 + HCl --> NaCl + CO2 + H2O
________(b-a)------------->(b-a)
=> nCaCO3(TN1) = nCO2(TN1) = b-a (mol)
TN2:
Na2CO3 + 2HCl --> 2NaCl + CO2 + H2O
__________b------------------>0,5b
=> nCaCO3(TN2) = nCO2(TN2) = 0,5b
Do mCaCO3(TN1) = m; mCaCO3(TN2) = 2m
=> 2. nCaCO3(TN1) = nCaCO3(TN2)
=> 2(b-a) = 0,5b
=> 2b - 2a = 0,5b
=> 2a = 1,5b
=> a : b = 3 : 4


b.
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓
0,24 ← 0,08 → 0,08
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
0,42 ← 0,14 → 0,14
Sau pứ: nNaOHdư = 0,74 – (0,24 + 0,42) = 0,08
NaOH + Al(OH)3 → NaAlO2 + 2H2O
0,08 → 0,08
Dư: 0,06
Suy ra m↓ = mFe(OH)3 + mAl(OH)3 = 0,08 . 107 + 0,06 . 78 = 13,24g

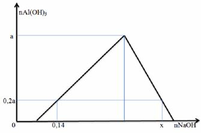
Vì nAl(OH)3 max = a → nAlCl3 = a
Giả sử số mol của AlCl3 và HCl trong mỗi phần là a, b
Bảo toàn Cl: 3a + b = 0,5 (1)
HCl + NaOH → NaCl + H2O
b → b
– Tại nNaOH = 0,14: kết tủa đang lên max (chưa bị hòa tan)
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
0,6a ← 0,2a
=> b + 0,6a = 0,14 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05
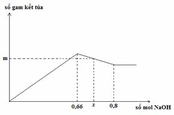
– Tại nNaOH = x: kết tủa bị hòa tan một phần
Al(OH)3 + NaOH → NaAlO2 + 2H2O
0,12 → 0,12
Dư: 0,03
→ x = 0,05 + 3.0,15 + 0,12 = 0,62 (mol)
Vậy x = 0,62

\(3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\\ Tacó:n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=0,3\left(mol\right)=a\\ \Rightarrow ChọnA\)
Pthh : 3NaOH+H3PO4-->Na3Po4+3H20
Theo pt : 3 mol 1 mol
Theo dbài: 0,9--> 0,3
Vậy giá trị của a là 0,3 mol
(www.facebook/dathunhungvanyeuem/

Na2CO3 + HCl → NaCl + NaHCO3
a........................a..................................a...........................(mol)
NaHCO3 + HCl → NaCl + CO2 + H2O
0,5a...................0,5a..........................................................................(mol)
Hiện tượng : Ban đầu không có hiện tượng gì, sau một thời gian xuất hiện bọt khí không màu không mùi.

Chọn A
Do phản ứng chỉ thu được muối N a 3 P O 4 do đó ta có phản ứng


1.cho mẫu kẽm vào ống nghiệm chứa dung dịch HCl (dư)
Ht: có khí k màu bay ra,viên kẽm bị tan hoàn toàn taoh thành dd k màu
pthh : Zn+2HCl=>ZnCl2+H2
2.cho mẫu nhôm vào ống nghiệm chứa H2SO4 đặc,nguội
k có hiện tượng xảy ra vì al k tác dụng với H2SO4 đặc,nguội.
3.Cho dây nhôm vào dung dịch NaOH đặc
Ht: có khí không màu thoát ra.dây ngôm bị tan hoàn toàn
pthh Al+NaOH+H2O=>NaAlO2 +3/2H2
4. cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd H2SO4
Ht: có kết tủa không tan màu trắng xuất hiện
pthh: BaCl2+H2SO4=>BaSO4+H2O
5.Cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dd Na2CO3
ht: xuất hiện chất kết tủa màu trắng
pthh: BaCl2+Na2CO3=>BaCO3+2NaCl
6.Cho từ từ dung dịch HCl vào ống nghiệm chứa dd NaOH có để sẵn 1 mẫu giấy quỳ tím
ht:quỳ tím từ màu xanh sang k màu hoặc nếu HCl dư thì quỳ tím màu đỏ,còn NaOH dư thì quỳ tím màu xanh
pthh: NaOH+HCl=>NaCl+H2O
7.cho đinh sắt vào ống nghiệm chứa dung dịch CuSO4
ht:có chất rắn màu đỏ bám vào đinh sắt
pthh: CuSO4+Fe=> Cu+FeSO4
8.cho dd NaOH từ từ vào ống nghiệm chứa dung dịch CuSO4.sau đó lọc lấy chất kết tủa rồi Đun nhẹ
ht: ban đầu xuất hiện chất kết tủa màu xanh,sau khi đun nhè thì chuyển thành màu đen
pthh: CuSO4+2NaOH=>Cu(OH)2+Na2SO4
Cu(OH)2=>CuO+H2O (Đk;Nhiệt độ)
9.Cho từ từ dung dịch AgNO3 vào ống nghiệm chứa dung dịch NaCl
ht:Xuất hiện kết tủa màu trắng là AgCl
pthh:AgNO3+NaCl=>AgCl+NaNO3
10.cho lá đồng vào ống nghiệm chứa dung dịch HCl
k có ht gì xảy ra
Good luck<3
Có gì k hiểu ib mình
a. Nhỏ từ từ dung dịch H3PO4 vào dung dịch NaOH:
H3PO4 + 3NaOH→Na3PO4+3H2O (1)
Vì \(\dfrac{0,12}{1}>\dfrac{0,2}{3}\) nên sau phản ứng (1), NaOH hết
=> nNa3PO4=\(\dfrac{1}{3}n_{NaOH}\)=\(\dfrac{1}{15}\) mol;
nH3PO4 phản ứng==\(\dfrac{1}{3}n_{NaOH}\)=\(\dfrac{1}{15}\) mol;
=> nH3PO4 dư=0,12−\(\dfrac{1}{15}\)=\(\dfrac{4}{75}\) mol
2Na3PO4+H3PO4→3Na2HPO4 (2)
Vì \(\dfrac{\dfrac{1}{15}}{2}< \dfrac{4}{75}\) nên sau phản ứng (2), Na3PO4 hết
nH3PO4 phản ứng=\(\dfrac{1}{2}\)nNa3PO4=\(\dfrac{1}{30}\) mol
=> nH3PO4 dư=\(\dfrac{4}{75}\) -\(\dfrac{1}{30}\) =\(\dfrac{1}{50}\) mol;
nNa2HPO4=\(\dfrac{3}{2}\)⋅nNa3PO4=0,1 mol
Na2HPO4+H3PO4→2NaH2PO4 (3)
Vì \(\dfrac{0,1}{1}>\dfrac{1}{\dfrac{50}{1}}\) nên sau phản ứng (3), H3PO4 hết
=> nNa2HPO4 phản ứng=nH3PO4=\(\dfrac{1}{50}\)mol
=> nNa2HPO4 dư=0,1−\(\dfrac{1}{50}\)=0,08 mol;
nNaH2PO4=2nH3PO4=0,04 mol
Vậy sau phản ứng thu được 0,08 mol Na2HPO4 và 0,04 mol NaH2PO4
b.Nhỏ từ từ dung dịch NaOH vào dung dịch H3PO4
H3PO4 + NaOH→NaH2PO4+H2O (1)
Vì \(\dfrac{0,12}{1}< \dfrac{0,2}{1}\) nên sau phản ứng (1), H3PO4 hết
=> nNaOH phản ứng=nH3PO4=0,12 mol
=> nNaOH dư=0,2−0,12=0,08 mol;
nNaH2PO4=nH3PO4=0,12 mol
NaH2PO4 + NaOH→Na2HPO4+H2O (5)
Vì \(\dfrac{0,08}{1}< \dfrac{0,12}{1}\) nên sau phản ứng (5), NaOH hết
=> nNaH2PO4 phản ứng=nNaOH=0,08 mol
=> nNaH2PO4 dư=0,12−0,08=0,04 mol;
nNa2HPO4=nNaOH=0,08 mol
Vậy sau phản ứng thu được 0,08 mol Na2HPO4 và 0,04 mol NaH2PO4