Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Oxyde: R2On
\(\Rightarrow\dfrac{16n}{2M_R+16n}=0,6\left(1\right)\)
Hợp chất với hydrogen: RH8-n
\(\Rightarrow M_R+8-n=17.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}M_R=32\left(g/mol\right)\\n=6\end{matrix}\right.\)
→ R là S.
⇒ SO3 và H2S

Đầu tiên, ta xác định nguyên tố R. Theo đề bài, oxyde cao nhất của R chứa 60% oxy theo khối lượng. Do đó, khối lượng của R chiếm 40%. Ta có công thức tính khối lượng nguyên tố trong hợp chất như sau:
MR=M0×4060
Trong đó, M0 là khối lượng phân tử của Oxy (16 đvC). Thay số vào công thức trên, ta được:
MR=16×4060=10.67≈11
Vậy nguyên tố R có khối lượng phân tử gần với 11 đvC, nên R có thể là nguyên tố Natri (Na).
Tiếp theo, ta xác định công thức của oxyde cao nhất của R. Vì oxyde cao nhất của Natri là Na2O, nên công thức của oxyde là Na2O.
Cuối cùng, ta xác định công thức của hợp chất khí của R với hydrogen. Theo đề bài, tỉ khối hơi của hợp chất này so với khí hydrogen là 17. Do đó, khối lượng phân tử của hợp chất này là 17 lần khối lượng phân tử của hydrogen. Ta có công thức tính khối lượng phân tử của hợp chất như sau:
MRH=17×MH
Trong đó, MH là khối lượng phân tử của Hydrogen (2 đvC). Thay số vào công thức trên, ta được:
MRH=17×2=34
Vì khối lượng phân tử của Natri là 23 đvC và khối lượng phân tử của Hydrogen là 1 đvC, nên công thức của hợp chất khí của R với hydrogen là NaH.
Vậy, R là Natri (Na), công thức oxyde của R là Na2O và công thức hợp chất khí của R với hydrogen là NaH.

Giả sử R thuộc nhóm n=>Công thức oxit cao nhất và hợp chất khí với hiđro lần lượt là R2On và RH8-n
- a:b=40:17
<=>\(\dfrac{R}{R+8-n}:\dfrac{2R}{2R+16n}=40:17lt;=gt;R=\dfrac{176n-230}{23}\)
Chỉ có giá trị n=6=>R= 32 thỏa mãn => R là lưu huỳnh (S)
-S là chất rắn màu vàng ở nhiệt độ thường=>Loại phương án C.
-Oxit cao nhất là SO3 ở điều kiện thường là chất khí =>Loại phương án B
16S:\(1s^22s^22p^63s^23p^4\) có 4 lớp electron ở phân lớp ngoài cùng => Loại phương án D
=>Đáp án A

Gọi CTHH của R với oxi là: R2O3
Theo đề, ta có: \(\%_{O_{\left(R_2O_3\right)}}=\dfrac{16.3}{NTK_R.2+16.3}.100\%=56,34\%\)
=> \(NTK_R\approx19\left(đvC\right)\)
=> R là flo (F)
=> CTHH của R và H là: FH3
CTHH của R và O là: F2O3

b) CT hợp chất của R với hidro là RH3
Có \(\dfrac{3}{M_R+3}.100\%=8,82\%=>M_R=31\left(P\right)\)
CT oxit cao nhất: P2O5
CT hidroxit: H3PO4
c) CT oxit cao nhất: RO2
\(\dfrac{32}{M_R+32}.100\%=53,3\%\) => MR = 28 (Si)

Chọn C
Oxit cao nhất của R có dạng R O 3 . Theo bài ra có:
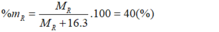
→ R = 32. Vậy R là lưu huỳnh (S).

