Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

Tham khảo
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)

Cho thanh kim loại A(Hóa trị 2) vào dung dịch C u N O 3 2 thấy khối lượng thanh kim loại giảm đi ⇒ M A > M C u ⇔ M A > 64.
Cho thanh kim loại A(Hóa trị 2) vào dung dịch P b N O 3 2 thấy khối lượng thanh kim loại tăng lên ⇒ M A < M P b ⇔ M A < 127 .
⇒ Chọn A.

Khi hoà tan hợp kim gồm 3 kim loại Fe, Cu và Al trong dung dịch HCl dư thì Cu không tác dụng, khối lượng 1,86 gam là khối ỉượng Cu. Gọi số mol Fe là x mol, Al là y mol.
n Fe = x mol
n Al = y mol
n H 2 = 3,024/22,4 = 0,135
Ta có hệ phương trình
56x + 27y = 6 - 1,86 = 4,14
x + 3/2y = 0,135
=> x = 0,045; y = 0,06
m Fe = 0,045 x 56 = 2,52g; n Al = 0,06 x 27 = 1,62g
Từ đó ta tính được thành phần phần trăm khối lượng các kim loại.

1. 2Al + 3Cl2 -to-> 2AlCl3 (1)
C1: mCl2=7,1(g)
=>nCl2=0,1(mol)
theo (1) : nAl=2/3nCl2=0,2/3(mol)
=>mAl=1,8(g)
khi Al ko tác dụng vs clo thì khối lượng vẫn giữ nguyên nhưng khi tác dụng với Cl2 thì khối lượng tăng lên => 7,1g là khối lượng Cl2
C2: giả sử nAl(pư)=x(mol)
theo (1) : nAlCl3=nAl=x(mol)
=>mAl=27x(g)
mAlCl3=133,5x(g)
=> 133,5x-27x=7,1(g)=>x=0,2/3(mol)
=>mAl=1,8(g)
2. hình như thiếu dữ kiện

m tăng là m Cl2 phản ứng:
nCl2 = \(\dfrac{4,26}{72}\)= 0,06 (mol)
PTHH: 2Al + 3Cl \(\rightarrow\) 2AlCl3
0,04mol \(\leftarrow\) 0,06mol
\(\rightarrow\) mAl = 0,04 x 27 = 1,08 (g)

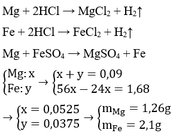
Fe hoặc Al đốt thì khối lượng tăng lên
Còn Vải sợi có khối lượng sẽ giảm sau khi đốt