Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi sục hh khí vào dd NaI bđ có pư
Cl2 + 2NaI = 2NaCl + I2
Trc pư 0,3 1,2
Sau pư 0 0,6 0,6
Sau đó , có pư
Br2 + 2NaI = 2NaBr + I2
Trc pư 0,5 0,6
Sau pư 0,2 0 0,6
=> m = 0,6 * (58,5 + 103) = 96,9 (g)

\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
Gọi a là mol NaI phản ứng; b là mol NaBr phản ứng
\(\Rightarrow0,5a+0,5b=0,5\left(1\right)\)
\(m_{NaI_{pư}}=150a\left(g\right)\)
\(m_{NaBr_{pư}}=103b\left(g\right)\)
\(n_{NaCl}=2n_{Cl2}=1\left(mol\right)\Rightarrow m_{NaCl}=58,5\left(g\right)\)
\(m_{A_{Dư}}=141,5-150a-103b\)
\(\Rightarrow m_{muoi_{pư}}=68,8\left(g\right)\)
\(\Rightarrow141,5-150a-103b+58,5=68,8\)
\(\Leftrightarrow-150a-103b=-121,2\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\left\{{}\begin{matrix}a=0,6\\b=0,4\end{matrix}\right.\)
NaBr phản ứng \(\Rightarrow\) NaI hết
\(\Rightarrow\) Trong 141,5g A có 0,6 mol NaI
\(\Rightarrow\%_{NaI}=\frac{0,6.150}{141,5}.100\%=63,6\%\)
\(\Rightarrow\%_{NaBr}=100\%-63,6\%=36,4\%\)

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
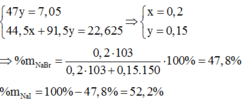

\(2NaBr + Cl_2 \to 2NaCl + Br_2\\ 2NaI + Cl_2 \to 2NaCl + I_2\\ n_{NaBr} + n_{NaI} = n_{NaCl} = \dfrac{2,94}{58,5} = 0,050256\)

\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
Ta có: \(n_{NaCl}=\dfrac{2,8665}{58,5}=0,049\left(mol\right)\)
Theo PT: \(n_{NaCl}=n_{NaBr}+n_{NaI}=0,049\left(mol\right)=x\)
Cho hỗn hợp muối có dạng NaX
PTHH : 2NaX + Cl2 -> 2NaCl + X2
Số mol NaCl \(\dfrac{2,866}{23+35,4}=0,05\left(mol\right)\)
-> molNaX = molNaCl = 0,05 mol

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M
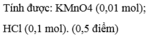
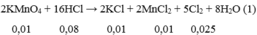

\(n_{NaBr}=0,2\left(mol\right);n_{NaI}=0,24\left(mol\right)\)
NaI bị oxi hoá trước NaBr
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Cl_2+2NaI\rightarrow2NaCl+I_2\)
Gọi x là mol Cl2 phản ứng
* TH1: dư NaI
\(\Rightarrow\) Tạo 2x mol NaCl; dư 0,24 - 2x mol NaI; 0,2 mol NaBr
\(\Rightarrow58,5.2x+150\left(0,24-2x\right)+103.0,2=38,3\)
\(\Rightarrow x=0,1\left(TM\right)\Rightarrow V=0,1.22,4=2,24\left(l\right)\)
* TH2: NaI vừa hết
\(\Rightarrow\) Tạo 0,24 mol NaCl; dư 0,2 mol NaBr
\(\Rightarrow58,5.0,24+103.0,2=38,3\)
\(\Rightarrow34,52=38,3\) (loại)
* TH3: NaI hết, dư NaBr
\(\Rightarrow\) Tạo 0,24 + 2x - 0,24= 2x mol NaCl; dư 0,2 - 2x + 0,24= 0,44 - 2x mol NaBr
\(\Rightarrow58,5.2x+103.\left(0,44-2x\right)=38,3\)
\(\Rightarrow x=0,079\left(mol\right)\left(TM\right)\Rightarrow V=0,079.22,4=1,7696\left(l\right)\)
* TH4: 2 muối hết
\(\Rightarrow\) Tạo 0,24 + 0,2 = 0,44 mol NaCl
\(\Rightarrow0,44.58,5=38,3\)
\(\Rightarrow25,72=38,3\) (loại)