Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 14
\(n_{O_2}=\dfrac{1.4}{22,4}=0,0625\left(mol\right)\)
\(n_P=\dfrac{2.5}{31}=0,0806451\left(mol\right)\)
4P + 5O2 ----to--->2P2O5
Xét tỉ lệ : \(\dfrac{0.0625}{5}< \dfrac{0.0806451}{4}\)
=> P ko cháy hết
bài 15
\(n_{O_2}=\dfrac{3.36}{22,4}=0,15\left(mol\right)\)
Gọi nFe = a ( mol ) và nS = b (mol )
PTHH :
S + O2 ---to---> SO2
3Fe + 2O2 ----to----> Fe3O4
Ta có 32b + 56a= 100
Theo PT : nS = nO2 = b (mol)
Theo PT : nO2 = 2/3 nFe = 2/3a ( mol)
=> 2/3a + b = 1,5
Từ những điều trên \(\left[{}\begin{matrix}56a+32b=100\\\dfrac{2}{3}a+b=1,5\end{matrix}\right.\Leftrightarrow\left[{}\begin{matrix}a=1,5\left(mol\right)\\b=0,5\left(mol\right)\end{matrix}\right.\)
\(m_{Fe}=1,5.56=84\left(g\right)\)
\(m_S=0,5.32=16\left(g\right)\)

\(n_{hhkhí}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Gọi \(n_{SO_2}=a\left(mol\right)\left(0< a< 0,75\right)\)
\(\rightarrow n_{O_2\left(dư\right)}=0,75-b\left(mol\right)\)
Ta có: \(\dfrac{64a+32\left(0,75-a\right)}{0,75}=\dfrac{33,6}{1}=33,6\left(\dfrac{g}{mol}\right)\)
\(\rightarrow a=0,0375\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,0375}{0,75}=5\%\\\%V_{O_2\left(dư\right)}=100\%-5\%=95\%\end{matrix}\right.\)

a) Phương trình phản ứng hóa học :
S + O2 \(\rightarrow\) SO2
b) Số mol lưu huỳnh tham gia phản ứng :
\(n_S=\frac{3,2}{32}=0,1\left(mol\right)\)
Theo phương trình, ta có : nSO2 = nS = nO2 = 0,1 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là :
VO2 = 22,4.0,1 = 2,24 (l)
Tương tự thể tích khí oxi cần dùng ở đktc là :
VO2 = 22,4.0,1 = 2,24 (l)
Vì khí oxi chiếm 20% về thể tích của không khí nên thể tích không khí cần dùng là :
Vkk = 5.VO2 = 5.2,24 = 11,2 (l)
Bạn Đặng Quỳnh Ngân có thể giải thích cho mk tại sao Vkk=5.VO2
mk chưa hiểu đoạn đó cảm ơn bạn

1. Khí hidro cháy trong không khí tạo ra nước
\(2H_2+O_2\rightarrow2H_2O\) ( có nhiệt độ )
2. Lưu huỳnh cháy trong bình chứa khí oxi tạo ra lưu huỳnh khí oxi(Biết trong hợp chất S có hóa trị IV)
\(S+O_2\rightarrow SO_2\) ( có nhiệt độ )
3. Phân hủy canxi cacbonat thành canxi oxi và khí cacbonic
\(CaCO_3\rightarrow CaO+CO_2\)
4, Cho bari hidroxit và lọ đựng nhôm sunfat sinh ra 2 chất rắn mới là bari sunfat và nhôm hidrxit
\(Al_2\left(SO_4\right)_3+3Ba\left(OH\right)_2\rightarrow2Al\left(OH\right)_3\downarrow+3BaSO_4\downarrow\)
5. Natri cho vào lọ đựng nước thu được natri hidroxit và khí hidro
\(2Na+2H_2O\rightarrow2NaOH+H_2\)

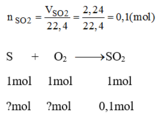
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
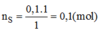
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
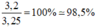

Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)
1: So sánh mức độ cháy của lưu huỳnh trong không khí và của lưu huỳnh trong oxi
- Lưu huỳnh cháy trong không khí vs ngọn lửa nhỏ,màu xanh nhạt.
- Lưu huỳnh cháy trong oxi mãnh liệt hơn, tạo thành khí lưu huỳnh đioxit SO2 và rất ít lưu huỳnh trioxit (S03).
2: So sánh mức độ cháy của photpho trong không khí và mức độ cháy của photpho trong oxi
- Khi đưa muỗng sắt có chứa một lượng nhỏ lưu huỳnh bột vào ngọn lửa đèn cồn, lưu huỳnh cháy trong không khí với ngọn lửa nhỏ màu xanh nhạt.
- Khi đưa lưu huỳnh đang cháy vào lọ có chứa khí oxi, lưu huỳnh cháy mãnh liệt hơn với ngọn lửa màu xanh.
3: Oxi có tác dụng được với hợp chất không?
- Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ. Vd: CH4; ...
https://hoc24.vn/vip/i_own_you