Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

Gọi công thức chung của 3 kim loại là R, vì là kiêm loại kiềm nên R hóa trị I.
R + H2O\(\rightarrow\) ROH +\(\frac{1}{2}\)H2
Ta có: nH2=\(\frac{11,2}{22,4}\)=0,5 mol \(\rightarrow\) nR=2nH2=1mol
\(\rightarrow\)M R=\(\frac{10}{1}\)=10 đvC
\(\rightarrow\)7<10<23\(\rightarrow\) X phải là Li \(\rightarrow\) Y là Na \(\rightarrow\) Z là K

TL
Hợp chất M được tạo từ 3 nguyên tố X, Y, Z. M có tổng số điện tích hạt nhân là 32, hiệu điện tích hạt nhân Z, Y là 1. Tổng số electron trong ion ZY3- là 32. Công thức phân tử của M là:
A. HNO3 B. HNO2 C. NaNO3 D. H3PO4
HT(MK NGHĨ VẬY THÔI)
Hợp chất M được tạo từ 3 nguyên tố X, Y, Z. M có tổng số điện tích hạt nhân là 32, hiệu điện tích hạt nhân Z, Y là 1. Tổng số electron trong ion ZY3- là 32. Công thức phân tử của M là:
A. HNO3 B. HNO2 C. NaNO3 D. H3PO4

(1) \(2H_2Se+O_2\underrightarrow{t^o}2H_2O+2Se\)
(2) \(2Cu\left(NO_3\right)_2\underrightarrow{t^o}2CuO+4NO_2\uparrow+O_2\uparrow\)
(3) \(4Sn+8HCl+2HNO_3\rightarrow5H_2O+N_2O\uparrow+4SnCl_4\)
(4) \(3Cu_2S+6FeS_2+40HNO_3\rightarrow6CuSO_4+3Fe_2\left(SO_4\right)_3+40NO\uparrow+20H_2O\)

a/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(3Cl_2+2Fe\underrightarrow{^{to}}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2NaCl+H_2SO_4\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow AgCl+Cu\left(NO_3\right)2\)
b/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2Na\underrightarrow{^{to}}2NaCl\)
\(2NaCl+H_2SO_{4_{dac}}\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
c/
\(MnO_2+4HCl_đ\underrightarrow{^{to}}MnO_2+Cl_2+2H_2O\)
\(Cl_2+2K\underrightarrow{^{to}}2KCl\)
\(2KCl+H_2SO_4\underrightarrow{^{to}}K_2SO_4+2HCl\)
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Br_2+2NaI\rightarrow NaBr+I_2\)
d/
\(2KMnO_4+16HCl_đ\underrightarrow{^{to}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow3AgCl+Fe\left(NO_3\right)_3\)

Xét hiệu độ âm điện các nguyên tố trong phân tử, ta có:
\(PH_3\): \(2,20-2,19=0,01< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(H_2S\): \(2,58-2,20=0,38< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.
\(NH_3\): \(3,04-2,20=0,84>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(BeCl_2\): \(3,16-1,57=1,59>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HF:\) \(3,98-2,20=1,78>1,7\text{ }\Rightarrow\) Liên kết ion
\(BF_3:\) \(3,98-2,04=1,94>1,7\text{ }\Rightarrow\) Liên kết ion
\(LiF:\) \(3,98-0,98=3,00>1,7\text{ }\Rightarrow\) Liên kết ion
\(ClO_2\): \(3,44-3,16=0,28< 0,4\text{ }\Rightarrow\) Liên kết cộng hoá trị không cực.

a. (1) 2KClO3 \(\underrightarrow{t}\) 3O2 + 2KCl
(2) 5O2 + 4P → 2P2O5
(3) P2O5 + H2O → 2H3PO4
b. (1) BaCO3 → BaO + CO2
(2) BaO + H2O → Ba(OH)2

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.
Đáp án D.
Ta có: số proton trung bình là:
Từ đó ta có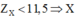 thuộc chu kì 1, 2 hoặc 3.
thuộc chu kì 1, 2 hoặc 3.
Xét các trường hợp:
Trường hợp 1: X thuộc chu kì 3 =>
Trường hợp 2: X thuộc chu kì 2 =>
=> Y thuộc chu kì 3 hoặc chu kì 4
+ Với Y thuộc chu kì 3 thì ta có
Cả hai kết quả thu được đều thỏa mãn
+ Với Y thuộc chu kì 4 thì ta có
Kết quả thu được cũng thỏa mãn.
- Trường hợp 3: X thuộc chu kì 1:
Cả hai kết quả thu được đều không thỏa mãn.
Do đó tất cả có 5 cặp nguyên tố thỏa mãn.