Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH:
3Mg + 8HNO3 ===> 3Mg(NO3)2 + 2NO + 4H2O
4,5a 3a
10Al + 36HNO3 ===> 10Al(NO3)3 + 3N2 + 18H2O
\(\frac{10a}{3}\) a
Vì tỉ khối của hỗn hợp khí so với Hidro là 14,75
=> Mhỗn hợp khí = 14,75 x 2 = 29,5 (g/mol)
Ta có sơ đồ đường chéo:
n1 mol NO có M = 30 (29,5 - 28)= 1,5
29,5
n2 mol N2 có M = 28 ( 30 - 29,5)= 0,5
=> \(\frac{n_1}{n_2}=\frac{1,5}{0,5}=\frac{3}{1}\)
Đặt số mol N2 là a (mol)
=> số mol của NO là 3a (mol)
Lập các sô mol trên phương trình:
Theo đề ra, ta có:
4,5a x 27 + \(\frac{10a}{3}.27=19,8\)
- Hòa tan hỗn hợp hai kim loại bằng dung dịch HCl
PTHH: Mg + 2HCl ===> MgCl2 + H2
0,4875 0,975
2Al + 6HCl ===> 2AlCl3 + 3H2
0,3 0,9
=> nHCl = 0,975 + 0,9 = 1,875 mol
=> mHCl = 1,875 x 36,5 = 68,4375 gam
=> mdung dịch HCl = 68,4375 / 7,3% = 937,5 gam
=> Vdung dịch HCl = 937,5 / 1,047 = 895,42

Phản ứng thế của X với clo theo tỷ lệ 1:1 khi chiếu sáng:
C 4 H 10 + Cl 2 → C 4 H 9 Cl + HCl

Chất có phản ứng thế với brom khi chiếu sáng . CH 3 - CH 2 - CH 3 ; CH 3 - CH 3
- Phản ứng thế với brom khi có mặt bột sắt và đun nóng : C 6 H 6 (benzen).
- Chất có phản ứng cộng với brom (trong dung dịch): CH 2 = CH 2 ; CH ≡CH.
Các chất tham gia phản ứng thế brom:
CH 3 - CH 2 - CH 3 + Br 2 → as CH 3 - CHCl - CH 3 (spc) + CH 3 - CH 2 - CH 2 Cl (spp) + HCl
CH 3 - CH 3 + Br 2 → as CH 3 - CH 2 Br + HBr
C 6 H 6 + Br 2 → bột Fe , t ° C 6 H 5 Br + HBr
Phản ứng cộng:
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4

Liên kết \(C\equiv C\)trong phân tử axetilen có hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hoá học.
-> Chọn C

Gọi công thức phân tử của A là C x H y , vì có 1 liên kết ba nên có phản ứng
C x H y + 2 Br 2 → C x H y Br 4
Ta có : 12x + y = 40.
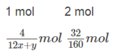
Vậy : Công thức phân tử của A là C 3 H 4

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

Nhận xét :
- Al có tính khử mạnh hơn Fe, Ag+ có tính oxi hóa mạnh hơn Cu2+ nên Al sẽ tác dụng với Ag+ trước và phản ứng cứ tiếp tục xảy ra.
- Dung dịch sau phản ứng không thấy màu xanh chứng tỏ Cu2+ hết (Ag+ hết) . Chất rắn sau phản ứng không tác dụng với dung dịch HCl, có nghĩa là trong chất rắn Z chỉ có Ag và Cu sinh ra; Al, Fe tham gia phản ứng hết.
Vậy, các chất đều tham gia phản ứng vừa đủ với nhau. Áp dụng định luật bảo toàn electron, viết các bán phản ứng, ta sẽ ra được đáp số.
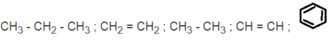
⇒ Chọn D.