Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Đáp án C
Fe + ddZ → khí NO => X chứa H N O 3 dư. Quy X về Fe và O
Trong X, đặt ![]()
Bảo toàn electron:
![]()
Giải hệ có: x = 0,12 mol; y = 0,09 mol
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
![]()
![]()
![]()

Đáp án C
Bài toán nhỏ “cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 tan hết trong dung dịch HNO3 loãng (dung dịch Y) thu được 1,344 lít NO (đktc) và dung dịch Z” → đủ giả thiết
Quy đổi 8,16 gam X gồm x mol Fe và y mol O → 56x + 16y = 8,16
Do thêm Fe vào Z tiếp tục thu được NO → chứng tỏ HNO3 còn dư trong Z → muối Fe trong Z là muối Fe3+
Bảo toàn electron ta có: 3x = 2y + 0,06.3.
Kết hợp giải hệ được x = 0,12mol, y = 0,09mol
Hòa tan tối đa Fe nên dung dịch sản phẩm cuối cùng chỉ chứa muối sắt II
Gộp cả quá trình → quan sát:
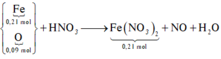
Bảo toàn electron có nNO = (0,21.2 – 0,09.2) : 3 = 0,08mol
Bảo toàn nguyên tố N có số mol HNO3 là 0,08 + 0,21.2 = 0,5mol

N+5 +1e =>N+4
0,02 mol<=0,02 mol
2N+5 +2.4e =>2N+1
0,04 mol<=0,01 mol
ne nhận=ne nhường=0,06 mol
nNO3- tạo muối=ne nhận=0,06 mol
=>mNO3-=0,06.62=3,72g
mKL=5,04g=>m muối=m gốc KL+mNO3-=3,72+5,04=8,76g
nHNO3 =0,06+0,02+0,005.2=0,09 mol
=>CM dd HNO3=0,09/0,1=0,9M
Phương trình nhận electron:
N+5 + 8e → N2O
N+5 +1e→NO2
nNO tạo muối = nNO + 8nN2O = 0,02 + 8.0,005 = 0.02 + 0,04 = 0,06 mol
mNO tạo muối =0,06.62 = 3,72g
m =mKL+ mNO tạo muối = 5,04 + 3,72 = 8,76g
nHNO3 tham gia phản ứng = 2nNO + 10nN2O = 2.0,02 + 10.0,005= 0,09 mol
x =0.09:0,1=0,9M ==>> Đáp án thứ nhất

Quy hỗn hợp về Fe và O với số mol lần lượt là a;b
$\Rightarrow 56a+16b=8,16$
Bảo toàn e ta được $3a-2b=0,06.3$
Giải hệ ta được $a=0,12;b=0,09$
Bảo toàn e cho phản ứng (2) ta có: $n_{NO}=0,02(mol)\Rightarrow n_{H^+/du}=0,08(mol)$
Dùng phương trình $H^+$ suy ra $n_{HNO_3}=0,5(mol)$
Coi hỗn hợp X gồm : Fe , O
\(n_{Fe}=a\left(mol\right),n_O=b\left(mol\right)\)
\(m_X=56a+16b=8.16\left(g\right)\left(1\right)\)
\(n_{NO}=\dfrac{1.344}{22.4}=0.06\left(mol\right)\)
\(\text{Bảo toàn e : }\)
\(3a=2b+3\cdot0.06\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.12,b=0.09\)
\(\text{Bảo toàn e cho cả quá trình : }\)
\(2n_{Fe}=3n_{NO\left(1\right)}+2n_{NO\left(2\right)}\)
\(\Rightarrow n_{NO\left(2\right)}=0.08\)
\(n_{HNO_3}=0.5\left(mol\right)\)



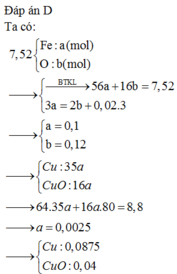

Đáp án C
=> Fe + ddZ -> khí NO chứa H N O 3 dư . Quy X về Fe và O
Trong X, đặt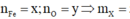
giải hệ có: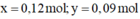
=>Xét cả quá trình : do hòa tan tối đa Fe => Fe chỉ lên số oxi hóa +2.
Bảo toàn electron cả quá trình: