Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Từ kí hiệu ta thấy nguyên tử Ar có số đơn vị điện tích hạt nhân là 18; vậy Ar có 18 prôtn, 18 electron và có 40-18= 22 nơtron
b) Lớp vỏ electron của nguyên tử có 18e được phân bố như sau : 1s2 2s2 2p6 3s2 3p6.

a) Nguyên tử của nguyên tố có 6 electron ở lớp ngoài cùng.
b) Cấu hình electron lớp ngoài cùng nằm ở lớp thứ ba.
c) Cấu hình electron của nguyên tố: 1s22s22p63s23p4.

a) Nguyên tử của nguyên tố có 6 electron ở lớp ngoài cùng.
b) Cấu hình electron lớp ngoài cùng nằm ở lớp thứ ba.
c) Cấu hình electron của nguyên tố: 1s22s22p63s23p4.

Các electron của nguyên tử nguyên tố X được phân bố trên 3 mức năng lượng, lớp thứ 3 có 6 electron, như vậy có sự phân bô” như sau: ls2 2s2 2p6 3s2 3p4
Số đơn vị điện tích hạt nhân của nguyên tử X là 16+
Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ ba có 6 electron.
=> Sự phân bố electron trong nguyên tử là: 1s2 2s2 2p6 3s2 3p4 ( Lớp 1 có 1 phân lớp chứa đủ 2 e, lớp 2 có 2 phân lớp chứa đủ 8 e, lớp 3 phân lớp s chứa đủ 2e => lớp p chứa: 6 (số e lớp thứ 3) - 2 (số e phân lớp s trong lớp thứ 3) = 4e )
Vậy nguyên tử nguyên tố X có 16 electron
=> Số đơn vị điện tích hạt nhân của nguyên tử X là 16+ ( số p = số e )
Nguyên tố X là lưu huỳnh ( S )

Trả lời :
\(HNO\): \(H-N=O\)
\(C_2N_2\): \(N\equiv C-C\equiv N\)
\(HCN\): \(H-C\equiv N\)
\(C_3O_2\): \(O=C=C=C=O\)
\(N_2O\): \(N\equiv N\rightarrow O\)

Trả lời : D đúng.
Các electron của nguyên tử nguyên tố X được phân bố trên 3 mức năng lượng, lớp thứ 3 có 6 electron, như vậy có sự phân bố như sau: ls2 2s2 2p6 3s2 3p4
Số đơn vị điện tích hạt nhân của nguyên tử X là 16+.

Gọi tổng số hạt proton, tổng số hạt nơtron, tổng số hạt electron lần lượt là Z, N, E.
Ta có N + Z + E = 13 vì Z = E nên 2Z + N = 13 (1)
2Z + N = 13 \(\rightarrow\) Z = 6,5 - N2N2 nên Z < 6,5.
Mặt khác từ nguyên tố số 2 đến 82 trong bảng tuần hoàn thì:
1 \(\le\)NZNZ \(\le\) 1,5 => N \(\le\)1,5Z thay vào (1), ta có:
3,5Z \(\ge\) 13 => Z \(\ge\)3,7
3,7 ≤ Z ≤ 6,5 (Z nguyên dương)
A = 13 - Z
Nguyên tố có Z = 4, nguyên tử khối là 9.
em ơi, em làm bài này có hiểu gì không em, chị L9 chị vẫn chưa làm đc, em siêu quá đấy !!!! Ngưỡng mộ quá ta ơi !! ![]()

a) Có 3 lớp electron nên nằm ở chu kỳ 3 trong bảng HTTH. Lớp ngoài cùng có 3 electron nên cấu hình sẽ là 3s23p1. Như vậy cấu hình electron là 1s22s22p63s23p1 (Z= 13 là Al)
b) Có 2 lớp electron nên nằm ở chu kỳ 2 trong bảng HTTH. Lớp ngoài cùng có 2 electron nên cấu hình sẽ là 2s2. Như vật cấu hình electron là 1s22s2 (Z= 4 là Be)
c) đang đề cập tới là cấu hình electron của ion Fe3+ . Số hiệu nguyên tử của Fe là 26.
d) đang đề cập tới là cấu hình electron của ion Zn2+ .Số hiệu nguyên tử của Zn là 30

Chọn câu C: số electron thuộc lớp ngoài cùng như nhau.

Số electron lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử bằng 3, 6, 9, 18 lần lượt là 1, 4, 7, 8. Do các nguyên tử có cấu hình electron như sau :
z = 3 : ls2 2S1 ; z = 6 : ls2 2s2 2p2 ;
z = 9 : ls2 2s2 2p5 ; z = 18 : ls2 2s2 2p6 3s2 3p6.
Số electron lớp ngoài cùng trong nguyên tử của các nguyên tố có số hiệu nguyên tử bằng 3, 6, 9, 18 lần lượt là 1, 4, 7, 8. Do các nguyên tử có cấu hình electron như sau :
z = 3 : ls2 2S1 ; z = 6 : ls2 2s2 2p2 ;
z = 9 : ls2 2s2 2p5 ; z = 18 : ls2 2s2 2p6 3s2 3p6.
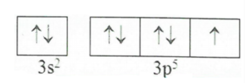
Cấu hình electron lớp ngoài cùng của X được phân bố: 3s23p5
→ X có cấu hình e: 1s22s22p63s23p5
X có số hiệu nguyên tử = số electron = 17 → Chọn D.