Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn e cho toàn quá trình.
Chất khử là Al,chất oxh là N+5
đặt số mol NO2l= là x, NÓ là y.
Ta có
-theo bài ra : x+y=0,04
-theo bảo toàn e : x+3y=(0,54/27)*3=0,06
giải ra đươc x=0,03 y=0,01
M hh khí = (0,03*46+0,01*30)/0,04=42
tỉ khối = 21

Axit sunfuric đặc giống tính chất axit sunfuric loãng ở chỗ :
- Đều hòa tan oxit kim loại(có hóa trị cao nhất) thành muối tương ứng và nước
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
- Đều phản ứng với dung dịch kiềm,bazo mà gốc kim loại có hóa trị cao nhất,...
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Khác nhau ở chỗ :
- hòa tan 1 số kim loại :
Axit sunfuric loãng không tác dụng với Cu
Axit sunfuric đặc có tác dụng với Cu :
$Cu + 2H_2SO_{4_{đặc}} \xrightarrow{t^o} CuSO_4 + SO_2 + 2H_2O$
- hòa tan oxit bazo :
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
Axit sunfuric đặc cũng có một số tính chất giống của axit sunfuric loãng là gì?
+ Làm quỳ hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với bazo
+ Tác dụng với oxit bazo
+ Tác dụng với muối
Ví dụ :
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Tính chất riêng :
Axit sunfuric đặc có đặc tính háo nước và tỏa nhiều nhiệt
C12H22O11 + 24H2SO4 → 12CO2 + 24SO2 + 35H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch H2SO4 đặc, nguội
Axit sunfuric đặc tác dụng với phi kim
C +2H2SO4 đặc nóng → CO2 +2SO2 + 2H2O
Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O

Các phát biểu không đúng: 2, 4, 6
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai.
6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Đáp án: C

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

Hỗn hợp A gồm 0,56 g Fe và 16 g Fe2O3.Trộn A với m gam bột nhôm rồi nungở nhiệt độ cao (không có không khí), thu được hỗn hợp D. Nếu cho D tan trong dung dịch H2SO4loãng dư thì thu được a lít khí, nhưng cho D tác dụng với dung dịch NaOH (dư) thì thể tích khí thu được là 0,25a lít (trong cùng điều kiện). Khoảng giá trị của m là
A. 0,54 < m < 2,70. B. 2,7 < m < 5,4.
C. 0,06 < m < 6,66. D. 0,06 < m < 5,4.
nFe = 0.01
nFe2O3 = 0.1
Gọi hiệu suất pứ nhiệt nhôm là h ( 0 < h < 1 )
h = 0
=> Al chưa pứ
nH2 do Fe sinh ra = (a - 0.25a)/22.4 = 0.01
=> a = 112/375
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => m = 0.06
h =1 :
Al dư,Fe2O3 hết
nAl pứ = 2nFe2O3 = 0.2
=> nFe = 0.1*2 + 0.01 = 0.21
nH2 do fe sinh ra = (a - 0.25a)/22.4 = 0.21
=> a = 6.272
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => nAl ban dầu = 5a/672 + 0.2 = 0.74/3
=> m = 6.66g
=> C 0,06 < m < 6,66

nAL=54:27=2 mol
nAL2O3=1mol
PTHH: 4Al+3O2=>2Al2O3
2 1
2->3/2<==3/2
=> mO2=1,5.32=48g
=> V O2=1,5.22,4=33,6l

a. PTHH: \(2SO_2+O_2\rightarrow^{t^o}_{V_2O_5}2SO_3\) (đoạn này Latex OLM đánh nhiều hơi rối nên không hiểu thì hỏi nhé)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(300ml=0,3l\)
\(\rightarrow n_{H_2SO_4}=1.0,3=0,3mol\)
Theo phương trình \(n_{O_2}=n_{SO_3}=n_{H_2SO_4}=0,3mol\)
\(\rightarrow m_{SO_2}=64.0,3=19,2g\)
b. PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(n_{Al_2O_3}=\frac{15,3}{102}=0,15mol\)
Xét tỉ lệ \(n_{Al_2O_3}>\frac{n_{H_2SO_4}}{3}\)
Vậy \(Al_2O_3\) dư
Theo phương trình \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{3}n_{H_2SO_4}=0,1mol\)
\(\rightarrow C_{M_{Al_2\left(SO_4\right)_3}}=\frac{0,1}{0,3}=0,33M\)
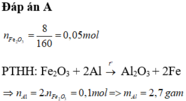
nhôm ko pứ với nước ở đk thường