Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

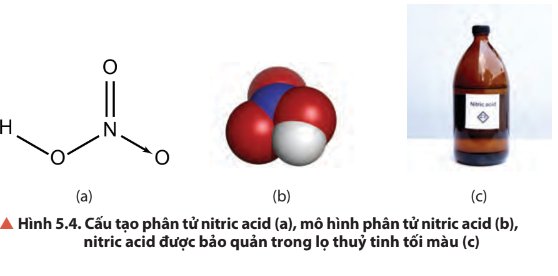
- Liên kết hoá học giữa các nguyên tử trong phân tử HNO3 là liên kết cộng hóa trị và liên kết cho nhận.
- Số oxi hóa của N trong HNO3 là +5. Đây là số oxi hóa cao nhất của N, do đó trong các phản ứng oxi hóa – khử, HNO3 là chất oxi hóa.

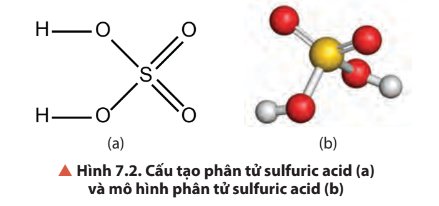
Phân tử có 2 liên kết đơn: H-O
2 liên kết đơn: S-O
2 liên kết đôi S=O

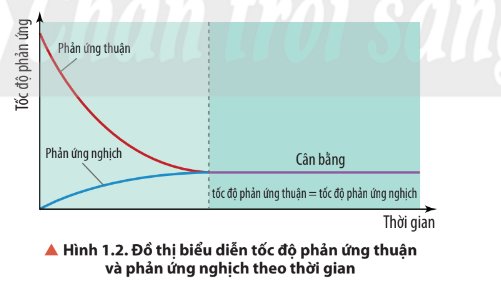
- Ban đầu:
+ Tốc độ phản ứng thuận giảm dần;
+ Tốc độ phản ứng nghịch tăng dần;
- Đến thời điểm cân bằng: Tốc độ phản ứng thuận = tốc độ phản ứng nghịch.

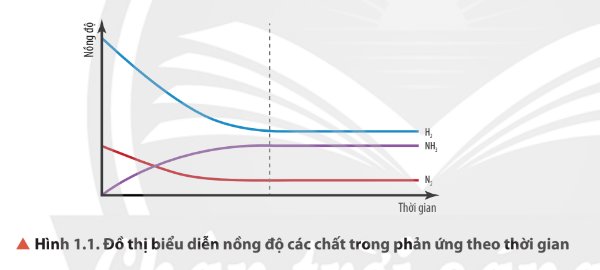
\(\left[N_2\right],\left[H_2\right]\) giảm, \(\left[NH_3\right]\) tăng.
Sau mốc thời gian nhất định, nồng độ các chất không thay đổi.

\(\Delta_rH^0_{298}=-1300kJ\) nên phản ứng là toả nhiệt.
Nhiệt lượng toả ra là 1 300 kJ nên dễ dàng thấy được phản ứng trên xảy ra thuận lợi. Hay ethanol dễ cháy, khi cháy toả nhiều nhiệt.

- Trong hình 2.4, H2O nhận H+ nên H2O là base.
- Trong hình 2.5, H2O nhường H+ nên H2O là acid.
- Trong cân bằng ion \(HCO_3^-\)
+ H2O nhận H+ nên H2O là base.
+ H2O nhường H+ nên H2O là acid.

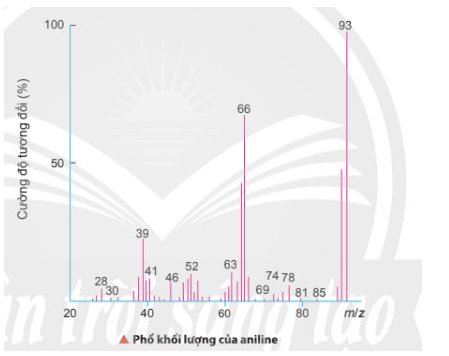
Gọi công thức phân tử của aniline là CxHyNz
\({\rm{\% }}{{\rm{m}}_{\rm{N}}}{\rm{ = 100\% - (77,42\% + 7,53\% ) = 15,05\% }}\)
Từ phổ khối lượng, ta có M = 93 (amu)
\(\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}}{\rm{ \times }}\frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{{\rm{77,42}}}}{{{\rm{12}}}}{\rm{ \times }}\frac{{{\rm{93}}}}{{{\rm{100}}}} \approx 6\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}}{\rm{ \times }}\frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{{\rm{7,53}}}}{{\rm{1}}}{\rm{ \times }}\frac{{93}}{{{\rm{100}}}} \approx {\rm{7}}\\{\rm{z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}}{\rm{ \times }}\frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{15,05}}{{{\rm{14}}}}{\rm{ \times }}\frac{{93}}{{{\rm{100}}}} \approx {\rm{1}}\end{array}\)
Công thức phân tử của aniline là \({{\rm{C}}_6}{{\rm{H}}_7}{\rm{N }}\)

Ở thời điểm kết thúc chuẩn độ, dung dịch trong bình tam giác có màu hồng nhạt.

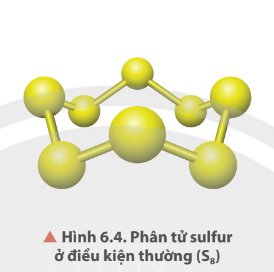
Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng.

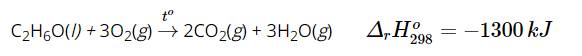


Trong phân tử nitrogen có liên kết ba bền vững với năng lượng liên kết lớn (945 kJ/mol).
Do đó ở nhiệt độ thường, phân tử nitrogen bền, khá trơ về mặt hóa học (khó phản ứng hóa học).