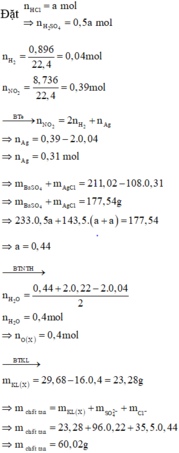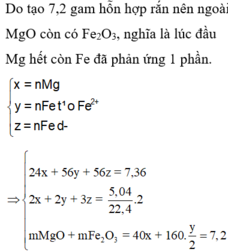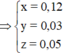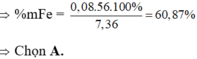Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

khi cho Fe vào HCl tạo Fe2+
áp dụng định luật bảo toàn e ta có:
Fe => Fe2+ + 2e 2H+ +2e => H2
nFe = 0,05 mol => mFe=2,8 g => mFe2O3 =7,2g => nFe2O3=0,045 mol
nói chung khi nung kết tủa trong không khí đều tạo Fe2O3 => m (chất rắn)= 7,6 g

- TN1: nH2 = 0,07875 mol => nAl dư = 0,07875.2/3 = 0,0525 mol.
nH2 do pư với HCl = 1,512/ 22,4 = 0,0675 mol => nFe = 0,0675 mol.
- TN2: gọi số mol Al dư là 0,0525x và số mol Fe là 0,0675x (x là tỷ lệ khối lượng giữa phần 1 và phần 2)
=> 0,0525x. 3/2 + 0,0675x = 9,828/22,4 => x = 3
Vậy trong hỗn hợp Y có nAl dư = 0,0525. 4 = 0,21 mol. nFe = 0,0675. 4= 0,27 mol.
pư: 8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,24 <------0,09 <-----------------0,27 mol
=> Hỗn hợp đầu có 0,24+ 0,21 = 0,45 mo, Al và 0,09 mol oxit sắt từ.
=> m = 0,45. 27 + 0,09. 232 = 33,03g

Đáp án A
Gọi số mol Cu, Fe, Fe3O4 lần lượt là x, y, z mol
→ 64x + 56y + 232z = 29,68
X + HNO3 dư sinh 0,39 mol NO2→ 2x + 3y + z = 0,39
Để kết tủa cực đại gồm BaSO4, Ag, AgCl
Vì AgNO3 dư nên hình thành Fe3+ , Cu2+
Bảo toàn electron:
→ nAg + 2nH2 = 2nCu + 3nFe + nFe3O4
→ nAg = 2x + 3y + z - 0,04.2
Bảo toàn nguyên tố H:
→ nHCl + 2nH2SO4 = 2nH2 + 2nO (Fe3O4) = 0,08 + 8z
Mà nHCl = 2nH2SO4 → nHCl = 0,04 + 4z mol, nH2SO4 = 0,02 + 2x
→ nBaSO4 = nH2SO4 = 0,02 + 2z
nAgCl = 2nBaCl2 + nHCl = 2. (0,02+ 2z ) + 0,04 + 4z = 0,08 + 8z mol
Kết tủa thu được 211, 02 gam
→ 233. (0,02 +2z) + 143,5 . (0,08 + 8z) + 108. (2x + 3y + z - 0,04.2) = 211, 02
→ 216x + 324y + 1722z= 203,52
Ta có hệ:
64 x + 56 y + 232 z = 29 , 68 2 x + 3 y + z = 0 , 39 216 x + 324 y + 1722 z = 203 , 52 → x = 0 , 04 y = 0 , 07 z = 0 , 1
→ m= mkl + mSO42- + mCl- = 29,68 - 0,1.4.16 + 96. ( 0,02+ 0,2) + 35,5. ( 0,04 + 0,4) = 60,02 gam.

Ở phản ứng 2 số mol H2 là nH2 = 0.448 / 22.4 = 0.02 mol Mg sẽ tham gia phản ứng trước
Mg + 2HCl = MgCl2+ H2
Fe + 2HCl = FeCl2 + H2
Nếu HCl ở phản ứng này vừa đủ hoặc dư thì ở phản ứng 1 chắc chắn sẽ dư. Do đó trong 3.34 gam chất rắn này sẽ có 3.1 gam FeCl2 và 0.24 gam MgCl2.-> n Fe = nFeCl2 = 3.1 / 127 >0.02 mol trong khi số mol H2 thu được của cả Mg và Fe tham gia phản ứng mới chỉ có 0.02 mol- không thỏa mãn. Như vậy trong phản ứng thứ 2 này. HCl đã thiếu -> số mol HCl có trong dung dịch = 2 số mol H2 = 0.04 mol
Quay trở lại phản ứng 1. Nếu như HCl vừa đủ hoặc dư thì số mol muối FeCl2 tạo thành nhỏ hơn hoặc bằng 0.02 mol tức là khối lượng FeCl2 sẽ nhỏ hơn hoặc bằng 127. 0.02= 2.54 gam. Trong khi thực tế lượng FeCl2 thu được là 3.1 gam. Do vậy HCl thiếu trong cả 2 phản ứng.
Trong phản ứng đầu tiên số mol FeCl2 = 1/2 n HCl = 0.04/2 = 0.02 mol -> khối lượng FeCl2 = 127.0,02 = 2.54 gam-> khối lượng Fe dư bằng 0.56 gam
-> a = 0.56 + 0.02 . 56 = 1.68 gam
Do cả 2 phản ứng đều thiếu HCl nên toàn bộ 0.04 mol Cl- sẽ tham gia tạo muối. Áp dụng định luật bảo toàn khối lượng -> khối lượng của Mg là b = 3.34 - 3.1 = 0.24 gam .
Tới đây là ra kết quả rồi. Có thể làm theo cách này nếu như không áp dụng định luật bảo toàn khối lượng
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol. Fe còn nguyên không phản ứng. Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi trên thực tế là 3.34 gam. Không thỏa mãn. Vậy có thể kết luận là Mg đã phản ứng hết và Fe phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
-> Hệ
95b/24 + 71x = 1.66
b/24 + x = 0.02 hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68
b = 0.24
Cho 0.03 mol Fe và b gam Mg vào 0.04 mol HCl thu được 3.1 gam chất rắn và 0.02 mol H2
Giả sử muối chỉ có MgCl2 thì khi đó số mol MgCl2 = 0.02 mol. Fe còn nguyên không phản ứng. Khi đó khối lượng chất rắn sẽ lớn hơn hoặc bằng 1.68 + 95. 0,02 = 3.58 gam trong khi trên thực tế là 3.34 gam. Không thỏa mãn. Vậy có thể kết luận là Mg đã phản ứng hết và Fe phản ứng 1 phần.
Mg------MgCl2
b/24---->b/24
Fe-------FeCl2
x---------x
Ta có 95b/24 + 127x +56. ( 0.03 - x) = 3.34
b/24 + x = 0.02
-> Hệ
95b/24 + 71x = 1.66
b/24 + x = 0.02 hay 95b/24 + 95 x = 1.9
Giải ra x = 0.01 mol
b = 0.24 gam
Vậy a = 1.68
b = 0.24

Đáp án A
Nhận thấy, nFe2+(dd Y) = nNO2 – 2nH2 = 0,39 – 2.0,04 = 0,31 mol
Giả sử nHCl = 2a; nH2SO4 = a
nBaSO4 = a, nAgCl = 4a, nAg = nFe2+ = 0,31 => 233a + 143,5.4a + 0,31.108 = 211,02 => a = 0,22
BTNT H => nHCl + 2nH2SO4 = 2nH2 + 2nH2O => nH2O = (0,44 + 2.0,22 – 2.0,04)/2 = 0,4 mol
BTKL: m = mX + mHCl + mH2SO4 – mH2 – mH2O = 29,68 + 0,44.36,5 + 0,22.98 – 0,04.2 – 0,4.18 = 60,02 gam

Đáp án C
Có mhỗn hợp rắn < mFe => Chứng tỏ X chưa tan hết.
=> Fe bị oxi hóa lên Fe(II)
Đặt số mol Fe phản ứng và Fe dư lần lượt là x, y.
24 . n Mg + 56 . m Fe = 7 , 36 g → BTe 2 . n Mg + 2 x + 3 y = 2 . n SO 2 = 2 . 5 , 04 22 , 4 = 0 , 45 mol m MgO + m Fe 2 O 3 = 40 . n Mg + 160 . x 2 = 7 , 2 g ⇒ n Mg = 0 , 12 mol x = 0 , 03 y = 0 , 05
⇒ % m Fe ( X ) = 56 . ( x + y ) 7 , 36 . 100 % = 60 , 87 %