Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Kali khi phản ứng hóa học có thể nhường đi bao nhiêu electron và vì sao ?
Mọi người giúp mình với nhé


\(26,1\left(g\right)kimloại+?O_2\underrightarrow{t^o}29,65\left(g\right)Oxit\)
\(BTKL:mO_2=3,55\left(g\right)\Rightarrow nO_2=0,11\left(mol\right)\)
\(\Rightarrow VO_{2\left(pứ\right)}=0,11.22,4=2,464\left(lít\right)\)

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
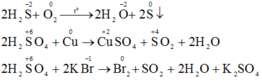

a)H2S chỉ thể hiện tính khử vì số oxi hóa của S ở mức thấp nhất :-2 .(Không thể giảm nên chỉ có tình khử)
H2SO4 chỉ thể hiện tính oxi hóa vì số oxi hóa của S ở mức cao nhất :6 . (Không thể tăng nên chỉ có tính oxi hóa)
b)H2S + Pb(NO3)2-->PbS + 2HNO3
H2SO4+ FeS -->H2S + FeSO4

S + O2 → SO2 (Dựa vào tính khử của S)
SO2 + 2H2S → 2S + 2H2O (Dựa vào tính oxi hóa của SO2)

- Cấu hình electron Na (Z = 11): 1s22s22p63s1 => Có 1 electron ở lớp ngoài cùng
=> Xu hướng cho đi 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- Cấu hình electron của Cl (Z = 17): 1s22s22p63s23p5 => Có 7 electron ở lớp ngoài cùng
=> Xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững
=> Dễ dàng tham gia phản ứng hóa học
- NaCl: Được tạo bởi 2 nguyên tố là Na và Cl. Trong hợp chất này Na sẽ nhường 1 electron và Cl sẽ nhận 1 electron của Na để đạt cấu hình có 8 electron ở lớp vỏ ngoài cùng
=> Cả 2 nguyên tử đều đạt cấu hình electron bền vững
=> NaCl khó tham gia các phản ứng mà có sự nhường hoặc nhận electron

BTKL ta có: \(24n_{Mg}+65n_{Zn}=12.5\left(g\right)\)
BT(e) ta có: \(2n_{Mg}+2n_{Zn}=2n_{H_2}=0.7\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0.25\left(mol\right)\\n_{Zn}=0.1\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}\%_{Mg}=48\\\%_{Zn}=52\end{matrix}\right.\)
khối lượng muối= \(0.25\cdot120+0.1\cdot161=46.1\left(g\right)\)
mk chỉ biết đến đây thôi
