Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

M (2+ ) : \(1s^22s^22p^63s^23p^4\)
=> có 16 e là S
\(X^-:1s^22s^22p^63s^23p^64s^1\)
=> 19 e là K
b, hợp chất tạo nên là \(K_2S\) bạn tự tính tổng số hạt nha

HD:
X- - 1e = X nên X có số hiệu điện tích Z = 10 - 1 = 9. X là Flo (F), KH: 919F

Xác định X+
X+ có 10 electron nên tổng proton trong 5 hạt nhân là 11
Z = 2,2. Vậy có 1 nguyên tử là H
Gọi nguyên tử thứ hai trong X+ là R, công thức X+ có thể là;
RH4+ : ZR + 4 = 11 → ZR = 7 (N) ; X+: NH4+ (nhận)
R2H3+ : 2ZR + 3 = 11 ZR = 4 loại : R3H2+ : 3ZR + 2 = 11 ZR = 3 loại
Xác định Y2-
Y2- có 32 eletron nên tổng số hạt proton trong 4 nguyên tử là 30.
= 7,5 2 nguyên tử trong Y2- đều thuộc cùng chu kỳ 2.
Gọi 2 nguyên tử là A, B: ZB = ZA +2
Công thức Y2- có thể là
AB32- : ZA + 3ZB = 30
ZB= ZA +2 ZA= 6 (C); ZB = 8 (O)
A2B22- : 2ZA+ 2ZB = 30
ZB = ZA + 2 ZA= 6,5; ZB = 8,5 loại
A3B2- : 3ZA + ZB = 30
ZB = ZA + 2 ZA = 7; ZB = 9 loại
Hợp chất A có công thức (NH4)2CO3
Ta có trong X+ nhé
Có 2 nguyên tố là a và b
Vì có 5 hạt nhân tức là có 5 nguyên tử mà chỉ có 10 e -> Chắc chắn phải có Hidro ( chứ nếu sang tới B là có tới 3 e rồi!)
Biện luận về số nguyên tử hidro và số e của nguyên tố còn lại (ntcl)<--- lưu ý là ion X+ có 10 -> tổng 2 nguyên tố có đến 11 e
Số Hidro : 1------2------3-----4
Số ntcl : 4------3------2-----1
Số e của ntcl:2.5----3------4-----7
Ta thấy chỉ có giá trị 4-1-7 là phù hợp bởi vì 2,5 lẻ bị loại, 3,4 là các nguyên tố kim loại ko tạo ion với Hiđro
Tra bảng tuần hoàn ta có số hiệu 7 là nguyên tố Nitơ. -> X+ là NH4+
Tổng số e trong Y 2- là 32 <=> tổng số e của 4 nguyên tố tạo nên Y2- là 30
Gọi số e của nguyên tố thứ nhất là a thì̀ số e của nguyên tố thứ 2 là a+2
lại gọi thêm số nguyên tử của 2 nguyên tố lần lượt là x,y thì ta có
x+y=4
xa + y(a+2) = 30 <=> xa + ya =28 - 2y <=> (x+y)a= 28 - 2y <=> 4a = 28 - 2y
biện luận
y-----1---------2---------3
a----6.5-----6.25------6
tới đây dừng vì y<4 ta thấy có 1 nguyên tố có 1 nguyên tử mang số hiệu 6 (oxi) -> nguyên tố còn lại mang số hiệu 8 (cacbon) và có 3 nguyên tử -> Y2- là CO3(2-)
-> A chính là ..... (NH4)2CO3

ion tạo ra từ X phải có cấu hình của khí hiếm => số e ở lớp vỏ ngoài cùng = 2 (giống He) hoặc 8. Mà cấu hình của X dừng ở 3p => chỉ có đáp án B thỏa mãn => X là 1s22s22p63s23p4 (S), ion X là S2-

a)
R có 17e → R nằm ở ô thứ 17
R có 3 lớp e → R thuộc chu kì 3
e cuối cùng của R điền vào phân lớp p → R thuộc nhóm A
R có 7e lớp ngoài cùng → R thuộc nhóm VIIA
b)\(X:1s^22s^22p^63s^1\)
X có 11e → X nằm ở ô thứ 11
X có 3 lớp e → X thuộc chu kì 3
e cuối cùng của X điền vào phân lớp s → X thuộc nhóm A
X có 1e lớp ngoài cùng → X thuộc nhóm IA
\(Y:1s^22s^22p^5\)
Y có 9e → R nằm ở ô thứ 9
Y có 2 lớp e → Y thuộc chu kì 2
e cuối cùng của Y điền vào phân lớp p → Y thuộc nhóm A
Y có 7e lớp ngoài cùng → Y thuộc nhóm VIIA
\(Z:1s^22s^22p^6\)
Z có 9e → R nằm ở ô thứ 10
Z có 2 lớp e → Z thuộc chu kì 2
e cuối cùng của Z điền vào phân lớp p → Z thuộc nhóm A
Z có 8e lớp ngoài cùng → Z thuộc nhóm VIIIA
c)\(X^-:1s^22s^22p^63s^23p^6\rightarrow X:1s^22s^22p^63s^23p5\)
X có 17e → X nằm ở ô thứ 17
X có 3 lớp e → X thuộc chu kì 3
e cuối cùng của X điền vào phân lớp p → X thuộc nhóm A
X có 7e lớp ngoài cùng → X thuộc nhóm VIIA
\(Y^{2+}:1s^22s^22p^63s^23p^6\rightarrow Y:1s^22s^22p^63s^23p^64s^2\)
Y có 20e → R nằm ở ô thứ 20
Y có 4 lớp e → Y thuộc chu kì 4
e cuối cùng của Y điền vào phân lớp s → Y thuộc nhóm A
Y có 2 lớp ngoài cùng → Y thuộc nhóm IIA
d)\(X^{3+}:1s^22s^22p^6\rightarrow X:1s^22s^22p^63s^23p^1\)
X có 13e → X nằm ở ô thứ 13
X có 3 lớp e → X thuộc chu kì 3
e cuối cùng của X điền vào phân lớp p → X thuộc nhóm A
X có 3e lớp ngoài cùng → X thuộc nhóm IIIA
\(Y^{2-}:1s^22s^22^6\rightarrow Y:1s^22s^22p^4\)
Y có 8e → Y nằm ở ô thứ 8
X có 2 lớp e → X thuộc chu kì 2
e cuối cùng của X điền vào phân lớp p → X thuộc nhóm A
X có 6e lớp ngoài cùng → X thuộc nhóm VIA

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
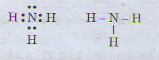

theo đề bài ta có : 2p+n=21 \(\Rightarrow\)n=21-2p
lại có \(1\le\dfrac{n}{p}\le1,5\Rightarrow p\le n\le1,5p\Rightarrow\dfrac{21}{3,5}\le p\le\dfrac{21}{3}\)
\(\Rightarrow6\le p\le7\)
\(\Rightarrow\left[{}\begin{matrix}p=6\\p=7\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}A=6+9=15\\A=7+7=14\end{matrix}\right.\)
trường hợp p=6 (loại ) p=7 (nhận)
vạy ta có cấu hình electron của nguyên tố là (p=7)
c.h.e:\(1s^22s^22p^3\)\(\Rightarrow\)đáp án B